Giải chuyên đề học tập Hoá học 10 Cánh diều bài 10: Tính tham số cấu trúc và năng lượng phân của phân tử
Dưới đây là phần hướng dẫn giải chi tiết cụ thể cho bộ chuyên đè học tập hoá học 10 Kết nối tri thức bài 10: Tính tham số cấu trúc và năng lượng phân của phân tử. Lời giải đưa ra ngắn gọn, cụ thể sẽ giúp ích cho em các em học tập ôn luyên kiến thức tốt, hình thành cho học sinh phương pháp tự học, tư duy năng động sáng tạo. Kéo xuống để tham khảo
1. Giới thiệu sơ lược về phần mềm tính toán (hóa học lượng tử) và bán kinh nghiệm
2. Cài đặt phần mềm MOPAC
3. Thực hiện tính và hiển thị kết quả
Luyện tập: Tính lại cấu trúc của C6H5OH trong dung môi nước. Các giá trị nhiệt tạo thành, năng lượng tổng, độ dài liên kết O-H và góc liên kết HOC là bao nhiêu?
Bước 1: Sử dụng ChemSketch để vẽ cấu trúc 2D của phenol; vào Tool chọn 3D Structure Optimization. Chọn 3D viewer để hiển thị cấu trúc 3D của chất này.
Bước 2: Trong 3D Viewer, vào menu chọn File, chọn Save As, đặt tên file là C6H5OH, lưu file dưới dạng .mop (phần Save As type chọn MOPAC Z – Matrix) vào một thư mục nào đó (chú ý, không để trong thư mục có đường dẫn bằng tiếng Việt).
Bước 3: Nhấn chuột phải lên file C6H5OH.mop, Open with NotePad, ở dòng trống trên cùng thêm lệnh OPT EPS=78.4 và ENPART (Lệnh xác định cấu trúc và năng lượng):
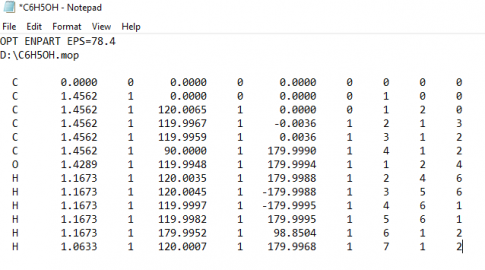
![]()
Sau đó vào file rồi Save
Bước 4: Nháy đúp chuột trái vào file C6H5OH. Mop, chương trình này sẽ chạy và kết thúc trong vài giây (nếu không thấy chạy thì nhấn chuột phải vào C6H5OH.mop, Open with để mở bằng MOPAC2016.exe nằm trong thư mục C:\Program Files\MOPAC). Thêm 2 file mới xuất hiện là file kết quả C6H5OH.out và C6H5OH. Arc.
Bước 5: Hiển thị kết quả
- Mở file C6H5OH. Out bằng NotePad.
- Phần kết quả:
![]()
![]()
Như vậy:
Giá trị nhiệt tạo thành trong dung môi nước là: -117,65887 kJ/mol
Năng lượng tổng: -1112,9781 EV
Để quan sát cấu trúc nhận được sau khi tính, nháy chuột phải lên file C6H5OH. arc, chọn rename để thêm mop vào cuối; nhận được file C6H5OH.arc.mop.
Trong menu File của 3D Viewer vào Open, phần File of Type chọn MOPAC Z – Matrix rồi chọn file C6H5OH.arc.mop sẽ hiện hình ảnh 3D của phenol.
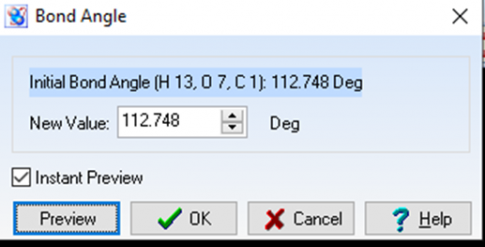
- Để biết độ dài liên kết, góc liên kết, chọn công cụ rồi nháy chuột lên các nguyên tử tương ứng. Kết quả được như sau:
rồi nháy chuột lên các nguyên tử tương ứng. Kết quả được như sau:
Độ dài liên kết O-H bằng: 0,999A

Độ dài góc liên kết HOC bằng: 112,748 độ
Bài tập
Bài 1:Sử dụng phương pháp PM7 để xác định đồng phân cis-2-butene hay trans-2-butene bền hơn. Biết rằng, đồng phân có năng lượng tổng âm hơn sẽ bền hơn:
Hướng dẫn trả lời:
Đồng phân cis-2-butene có năng lượng tổng là -599,1911 EV
(Phần kết quả: ![]() )
)
Đồng phân trans-2-butene có năng lượng tổng là -599,2290 EV
(Phần kết quả: ![]() )
)
⇒ trans-2-butene bền hơn do có năng lượng tổng âm hơn.
Bài 2: Sử dụng phương pháp PM7 tính cấu trúc (độ dài liên kết, góc liên kết), nhiệt tạo thành, năng lượng tổng của 3 đồng phân o, m, p-cresol. So sánh độ bền giữa các đồng phân.
Hướng dẫn trả lời:
Sử dụng phương pháp PM7 ta có bảng sau:
Đồng phân | o-cresol | m-cresol | p-cresol | |
Nhiệt tạo thành (kJ/mol) | -129,08980 | -134,94981 | -130,75217 | |
Năng lượng tổng (EV) | -1263,1321 | -1263,1939 | -1263,1509 | |
Độ dài liên kết ($\overset{o}{A}$) | d(C-O) | 1,36 | 1,359 | 1,36 |
d(O-H) | 0,987 | 0,987 | 0,987 | |
d(C-CH3) | 1,489 | 1,491 | 1,491 | |
Góc liên kết (o) | $\widehat{COH}$ | 112,336o | 112,251o | 112,141o |
Đồng phân có năng lượng tổng âm hơn sẽ bền hơn. Dựa vào kết quả ta thấy độ bền của các đồng phân được sắp xếp như sau: o-cresol < p-cresol < m-cresol.
Bài 3: Cho dãy hợp chất H2X, với X là các nguyên tố nhóm VIA gồm O, S, Se. Sử dụng phương pháp tính PM7 để tối ưu hóa cấu trúc, từ đó tính độ dài liên kết X-H và góc HXH. Tìm quy luật biến đổi các giá trị này trong dãy nêu trên.
Hướng dẫn trả lời:
Với hợp chất H2O:
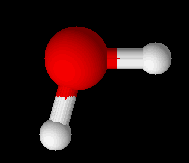
d(O-H) = 0,956$\overset{o}{A}$

Góc $\widehat{HOH}= 105,399^{o}$
Với hợp chất H2S:
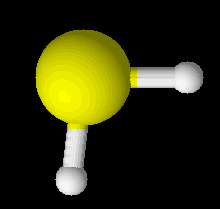
d(S-H) = 1,339$\overset{o}{A}$
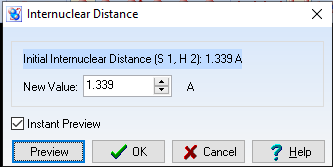
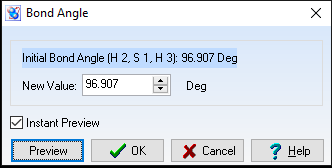
Góc $\widehat{HSH}= 96,907^{o}$
Với hợp chất H2Se:
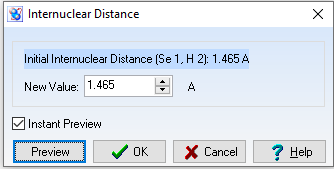
d(Se-H) = 1,465$\overset{o}{A}$
Góc $\widehat{HSeH}= 93,752^{o}$

Nhận xét:
Trong nhóm VIA từ O đến Se độ dài liên kết X-H tăng dần; góc liên kết HXH giảm dần.
Bài 4: Sử dụng phương pháp PM7 để tối ưu hóa cấu trúc, từ đó tính (độ dài liên kết, góc liên kết) các chất có trong các phương trình phản ứng sau:
O2(g) + 2H2(g) → 2H2O(g) (1)
F2(g) + H2(g) → 2HF (g) (2)
a) Tính biến thiên enthalpy của phản ứng (1) và (2) theo phương pháp PM7. So sánh kết quả nhận được với kết quả tính từ enthalpy tạo thành chuẩn của các chất trong Phụ lục 2.
b*) Tính biến thiên năng lượng của phản ứng (1) và (2). Từ đó, so sánh khả năng phản ứng của oxygen và fluorine với hydrogen.
Biết rằng, biến thiên năng lượng của phản ứng cũng được tính giống như biến thiên enthalpy của phản ứng, nhưng thay nhiệt tạo thành bởi năng lượng tổng của phân tử.
Chú ý: Enthalpy tạo thành chuẩn của các đơn chất ở trạng thái bền bằng 0.
Hướng dẫn trả lời:
a) Tính biến thiên enthalpy của phản ứng (1) và (2) theo phương pháp PM7:
$\Delta _{f}H_{298}^{o}$(H2O) = -241,83333 kJ/mol
$\Delta _{f}H_{298}^{o}$ (HF) = -259,13839 kJ/mol
$\Delta _{r}H_{298}^{o}$(1) = 2. $\Delta _{f}H_{298}^{o}$(H2O) – 1.0 – 2.0 = 2.(-241,83333) = -483,66666 kJ
$\Delta _{r}H_{298}^{o}$ (2)= 2. (HF) – 1.0 – 1.0 = 2.(-259,13839) = -518,27678 kJ
Tính biến thiên enthalpy của phản ứng (1) và (2) theo enthalpy tạo thành ở phụ lục 2:
$\Delta _{f}H_{298}^{o}$(H2O) = -241,8 kJ.mol-1
$\Delta _{f}H_{298}^{o}$ (HF) = -273,3 kJ.mol-1
$\Delta _{r}H_{298}^{o}$(1) = 2. (H2O) – 1.0 – 2.0 = 2.(-241,8) = -483,6 kJ
$\Delta _{r}H_{298}^{o}$(2) = 2. (HF) – 1.0 – 1.0 = 2.(-273,3) = -546,6 kJ
So sánh: Kết quả nhận được với kết quả tính từ enthalpy tạo thành chuẩn của các chất trong Phụ lục 2 là xấp xỉ nhau.
b*) Biến thiên năng lượng của phản ứng (1)
$\Delta _{r}H_{298}^{o}$= 2.năng lượng tổng H2O – (năng lượng tổng O2 + 2.năng lượng tổng H2)
= 2. (-322,6792) – [-585,9147 + 2.( -28,0470)] = -3,3497 eV
Biến thiên năng lượng của phản ứng (2)
$\Delta _{r}H_{298}^{o}$ = 2.năng lượng tổng HF – (năng lượng tổng F2 + năng lượng tổng H2)
= 2.(-479,5304) – [-927,7183 + (-28,0470)] = -3,2955 eV
Nhận xét:
Phản ứng giữa hydrogen và fluorine xảy ra thuận lợi hơn.
Bài 5: Bằng cách tối ưu hóa cấu trúc, hãy xác định độ dài các liên kết H–X (với X là F, Cl, Br, I).
Hướng dẫn trả lời:
Bằng cánh tối ưu hoá cấu trúc, độ dài các liên kết lân lượt bằng
d(H–F) = 0,896 $\overset{o}{A}$
d(H–Cl) = 1,273 $\overset{o}{A}$
d(H–Br) = 1,459 $\overset{o}{A}$
d(H–I) = 1,637 $\overset{o}{A}$
