Tải giáo án Powerpoint Hóa học 11 KNTT bài 3: Ôn tập chương 1
Tải bài giảng điện tử powerpoint Hóa học 11 Kết nối tri thức bài 3: Ôn tập chương 1. Bài học được thiết kể đẹp mắt, nội dung giảng dạy hay nhiều trò chơi và video phong phú thu hút học sinh tập trung nắm bắt kiến thức quan trong. Giáo án tải về chỉnh sửa được. Kéo xuống để xem chi tiết
Rõ nét về file powerpoint trình chiếu. => Xem thêm
CHÀO MỪNG CÁC EM ĐẾN VỚI BÀI HỌC HÔM NAY!
KHỞI ĐỘNG
Hoàn thành phiếu học tập
- Cân bằng hóa học
|
......................................................... aA + bB cC + dD Phản ứng chỉ xảy ra ................... từ chất đầu tạo thành sản phẩm |
Phản ứng thuận nghịch ......................................................... Trong cùng điều kiện, phản ứng xảy ra theo ................... trái ngược nhau |
|
Trạng thái cân bằng |
vthuận = .............. ; nồng độ các chất trong hệ phản ứng .......................... |
|
Hằng số cân bằng |
Kc = Trong đó: ..........................................................Chất rắn không đưa vào biểu thức tính KC KC chỉ phụ thuộc vào .......................... |
|
Các yếu tố ảnh hưởng đến cân bằng hóa học |
........................................................ |
|
Nguyên lí chuyển dịch cân bằng Le Chatelier |
.............................................................. |
- Cân bằng trong dung dịch nước
- a) Sự điện li
Khái niệm: ..............................................................................................................
Chất điện li mạnh: ..................................................................................................
Chất điện li yếu: .....................................................................................................
Chất không điện li: .................................................................................................
- b) Thuyết acid – base của Bronsted – Lowry
Acid là.....................................................................................................................
Base là....................................................................................................................
- Cân bằng trong dung dịch nước
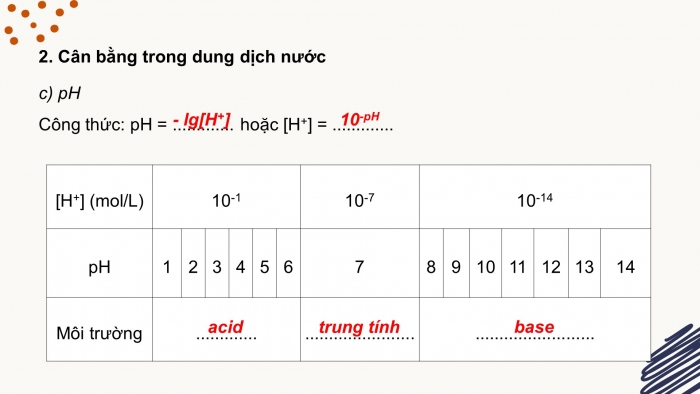
- c) pH
Công thức: pH = ............. hoặc [H+] = .............
|
[H+] (mol/L) |
10-1 |
10-7 |
10-14 |
|||||||||||
|
pH |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
|
Môi trường |
............. |
....................... |
......................... |
|||||||||||
- d) Phản ứng thủy phân
Khái niệm: ..................................................................................................................................................................................................................................................................
Phương trình phản ứng của các ion Al3+, Fe3+ và
.................................................................................................................................
.................................................................................................................................
..................................................................................................................................................................................................................................................................
BÀI 3: ÔN TẬP CHƯƠNG I
LUYỆN TẬP
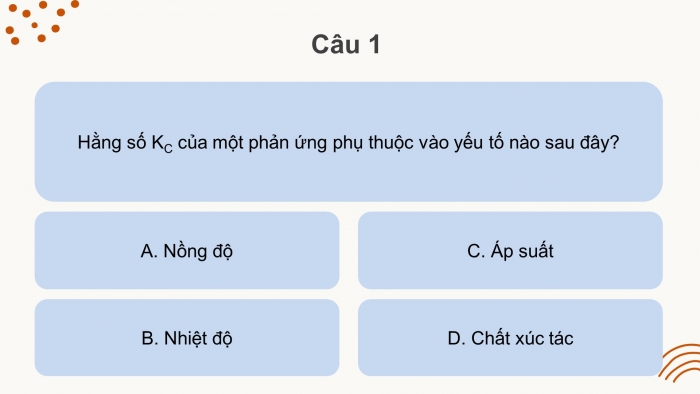
Câu 1
Hằng số KC của một phản ứng phụ thuộc vào yếu tố nào sau đây?
- Nồng độ
- Nhiệt độ
- Áp suất
- Chất xúc tác
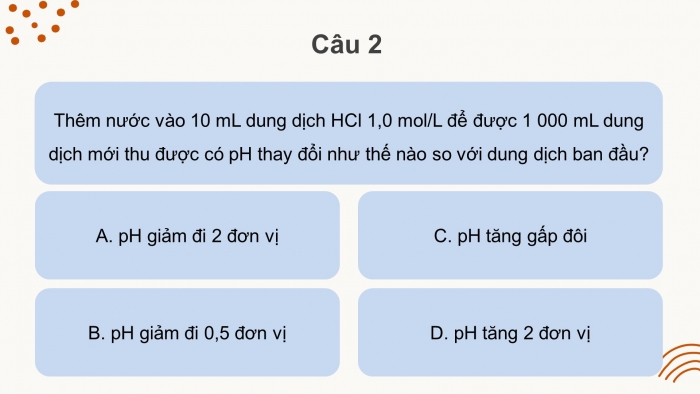
Câu 2
Thêm nước vào 10 mL dung dịch HCl 1,0 mol/L để được 1 000 mL dung dịch mới thu được có pH thay đổi như thế nào so với dung dịch ban đầu?
- pH giảm đi 2 đơn vị
- pH giảm đi 0,5 đơn vị
- pH tăng gấp đôi
- pH tăng 2 đơn vị
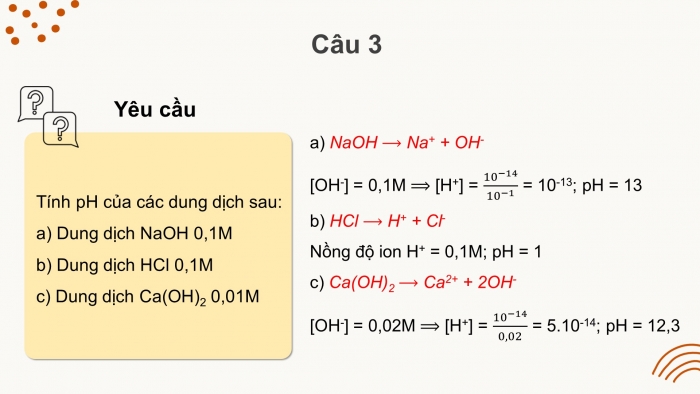
Câu 3
Yêu cầu
Tính pH của các dung dịch sau:
- a) Dung dịch NaOH 0,1M
- b) Dung dịch HCl 0,1M
- c) Dung dịch Ca(OH)2 0,01M
- a) NaOH Na+ + OH-
[OH-] = 0,1M [H+] = = 10-13; pH = 13
- b) HCl H+ + Cl-
Nồng độ ion H+ = 0,1M; pH = 1
- c) Ca(OH)2Ca2+ + 2OH-
[OH-] = 0,02M [H+] = = 5.10-14; pH = 12,3
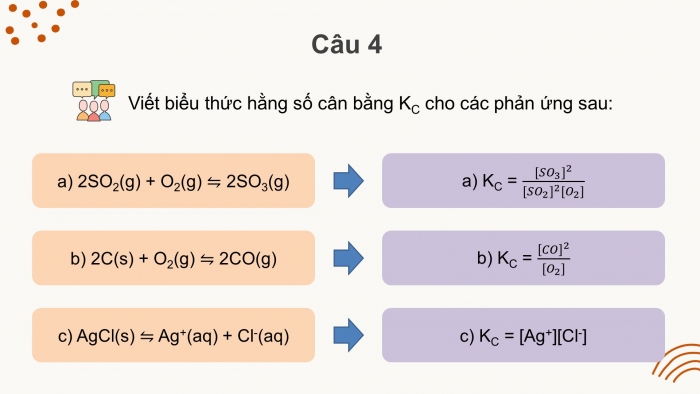
Câu 4
Viết biểu thức hằng số cân bằng KC cho các phản ứng sau:
- a) 2SO2(g) + O2(g) 2SO3(g)
> a) KC =
- b) 2C(s) + O2(g) 2CO(g)
> b) KC =
- c) AgCl(s) Ag+(aq) + Cl-(aq)
> c) KC = [Ag+][Cl-]
Câu 5
Cho cân bằng hóa học sau: H2(g) + I2(g) 2HI(g)
Nhận xét nào sau đây không đúng?
- Khi tăng nhiệt độ, cân bằng trên chuyển dịch theo chiều nghịch
- Ở nhiệt độ không đổi, khi tăng áp suất thì cân bằng không bị chuyển dịch
- Ở nhiệt độ không đổi, khi tăng nồng độ H2 hoặc I2 thì giá trị hằng số cân bằng tăng
- Ở trạng thái cân bằng, tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch
Câu 6
Xét phản ứng xảy ra trong lò luyện gang:
Fe2O3(s) + 3CO(g) 2Fe(s) + 3CO2(g)
Nêu các yếu tố (nồng độ, nhiệt độ, áp suất) cần tác động vào cân bằng trên để cân bằng chuyển dịch về bên phải (làm tăng hiệu suất của phản ứng)?
Nồng độ: Tăng nồng độ của chất tham gia (tăng nồng độ của CO) hoặc giảm nồng độ của chất sản phẩm (giảm nồng độ của khí CO2)
Nhiệt độ: Cân bằng trên là tỏa nhiệt, vì vậy khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều thuận
Áp suất: Số mol khí vế bên phải và bên trái bằng nhau, vì vậy khi tăng/giảm áp suất, cân bằng đều không dịch chuyển
Câu 7
Cho cân bằng hóa học sau: CO(g) + H2O(g) H2(g) + CO2(g)
Ở 427 oC, hằng số cân bằng KC = 8,3. Cho 1 mol khí CO và 1 mol hơi nước vào bình kín dung tích 10 lít và giữ ở 427oC. Tính nồng độ các chất ở trạng thái cân bằng.
CO(g) + H2O(g) H2(g) + CO2(g)
Ban đầu 1,0 mol 1,0 mol
Phản ứng x x x x
Cân bằng 1 – x 1 – x x x
KC = 8,3 x = 0,742
Nồng độ các chất ở trạng thái cân bằng:
[H2] = 0,0742 mol/L
[CO2] = 0,0742 mol/L
[CO] = 0,0258 mol/L
VẬN DỤNG
HÁI HOA DÂN CHỦ
Hình ảnh về file sile, ppt trình chiếu







.....
=> Còn nữa.... Files tải về, sẽ có đầy đủ nội dung bài học
Nâng cấp lên tài khoản VIP để tải tài liệu và dùng thêm được nhiều tiện ích khác
Từ khóa tìm kiếm:
Bài giảng điện tử Hóa học 11 KNTT, Tải giáo án Powerpoint Hóa học 11 kết nối bài 3: Ôn tập chương 1, giáo án powerpoint Hóa học 11 kết nối tri thức bài 3: Ôn tập chương 1
