Tải giáo án Powerpoint Hóa học 11 KNTT bài 5: Ammonia, Muối ammonium
Tải bài giảng điện tử powerpoint Hóa học 11 Kết nối tri thức bài 5: Ammonia, Muối ammonium. Bài học được thiết kể đẹp mắt, nội dung giảng dạy hay nhiều trò chơi và video phong phú thu hút học sinh tập trung nắm bắt kiến thức quan trong. Giáo án tải về chỉnh sửa được. Kéo xuống để xem chi tiết
Rõ nét về file powerpoint trình chiếu. => Xem thêm
CHÀO MỪNG CẢ LỚP ĐẾN VỚI BÀI HỌC HÔM NAY!
KHỞI ĐỘNG
TRÒ CHƠI Ô CHỮ
Luật chơi:
- Có 8 từ hàng ngang tương ứng với 8 câu hỏi gợi ý bất kỳ.
- Các em dựa vào gợi ý và tìm từ hàng ngang tương ứng với số ô chữ của mỗi hàng.
- Sau khi lật mở hết từ hàng ngang, em hãy đọc từ hàng dọc xuất hiện trong trò chơi.
Ô số 1 (4 chữ cái): Loại phân đạm phổ biến ở Việt Nam?
Ô số 2 (3 chữ cái): Số cặp electron không liên kết trong phân tử ammonia là bao nhiêu?
Ô số 3 (3 chữ cái): Loại phân bón nào cung cấp nguyên tố nitrogen hóa học cho cây trồng?
Ô số 4 (8 chữ cái): Khi phân tử ammonia nhận thêm proton thì sẽ trở thành ion gì?
Ô số 5 (6 chữ cái): Nhận xét đúng về độ tan của ammonia trong nước?
Ô số 6 (4 chữ cái): Khí ammonia có mùi gì?
Ô số 7 (7 chữ cái): Trong công nghiệp, phần lớn ammonia được dùng để sản xuất mặt hàng nào?
BÀI 5: AMMONIA – MUỐI AMMONIUM
KHỞI ĐỘNG
Nêu một số dụng cụ, hóa chất, thiết bị đo phòng thí nghiệm mà em biết.
NỘI DUNG BÀI HỌC
Ammonia
Muối ammonium
- AMMONIA
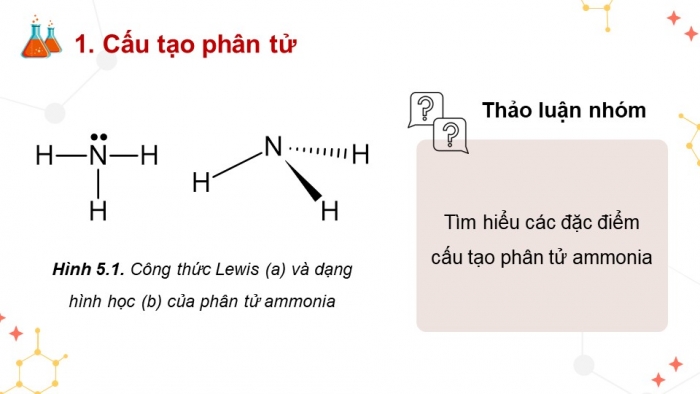
- Cấu tạo phân tử
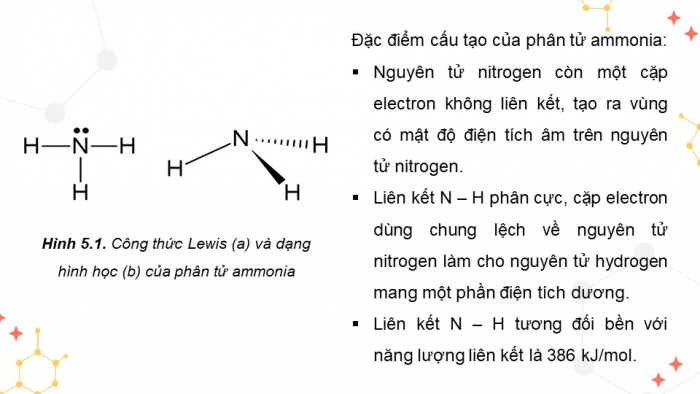
Hình 5.1. Công thức Lewis (a) và dạng hình học (b) của phân tử ammonia
Thảo luận nhóm
Tìm hiểu các đặc điểm cấu tạo phân tử ammonia
Đặc điểm cấu tạo của phân tử ammonia:
- Nguyên tử nitrogen còn một cặp electron không liên kết, tạo ra vùng có mật độ điện tích âm trên nguyên tử nitrogen.
- Liên kết N – H phân cực, cặp electron dùng chung lệch về nguyên tử nitrogen làm cho nguyên tử hydrogen mang một phần điện tích dương.
- Liên kết N – H tương đối bền với năng lượng liên kết là 386 kJ/mol.
Trả lời câu hỏi HĐ I.1 (SGK tr.33):
- Viết cấu hình electron của các nguyên tử H (Z = 1) và N (Z = 7)
- Trình bày các bước lập công thức Lewis của phân tử ammonia
- Cấu hình electron của nguyên tử H là 1s1, của nguyên tử N là 1s22s22p3.
- Đặt 3 cặp electron giữa N và 3H (a), đặt cặp electron vào nguyên tử N, thu được công thức electron (b), thay mỗi cặp electron liên kết bằng một gạch hóa trị, thu được công thức Lewis (c):
- Tính chất vật lí
Đọc thông tin mục I.2 SGK tr.34, tìm hiểu về tính chất vật lí của ammonia
- Ở điều kiện thường, ammonia tồn tại ở thể khí, không màu, nhẹ hơn không khí, mùi khai và xốc.
- Ammonia tan nhiều trong nước.
- Ammonia dễ hóa lỏng và dễ hóa rắn.
Xem thí nghiệm Tính tan của ammonia trong nước và trả lời CH2 (SGK tr.34): Hãy giải thích tại sao ammonia tan tốt trong nước?
Giữa các phân tử ammonia (chất tan) và phân tử nước (dung môi) có tương tác mạnh nên ammonia phân tán tốt vào nước, tức tan tốt trong nước.
Hai tương tác cơ bản giữa các phân tử ammonia và nước là liên kết hydrogen và tương tác van der Waals (phân tử ammonia và nước đều phân cực mạnh).
- Tính chất hoá học
- Tính base
Dung dịch ammonia có môi trường base yếu, làm quỳ tím chuyển màu xanh, phenolphthalein chuyển màu hồng.
Câu hỏi HĐ I.3 (SGK tr.34):
Trong công nghiệp, phản ứng giữa ammonia với acid được dùng để sản xuất phân bón:
NH3 + HCl NH4Cl
NH3 + HNO3 NH4NO3
2NH3 + H2SO4 (NH4)2SO4
Xác định chất cho, chất nhận proton trong mỗi phản ứng trên. Dùng mũi tên để biểu diễn sự cho, nhận đó.
Trong các phản ứng trên:
- NH3 nhận proton (H+) ®
- HCl, HNO3 và H2SO4 nhường proton ®
- Tính khử
- Trong phân tử ammonia, nguyên tử nitrogen có số oxi hoá -3 ® Thể hiện tính khử.
- Khi đốt cháy oxygen, ammonia cháy với ngọn lửa màu vàng.
4NH3 + 3O2 2N2 + 6H2O
- Trong công nghiệp, phản ứng giữa ammonia và oxygen được thực hiện ở 800 - 900˚C, xúc tác Pt.
4NH3 + 5O2 4NO + 6H2O
- Ứng dụng
Đọc thông tin (SGK tr.35), tìm hiểu một số ứng dụng của ammonia
Một số ứng dụng của ammonia
Hình ảnh về file sile, ppt trình chiếu







.....
=> Còn nữa.... Files tải về, sẽ có đầy đủ nội dung bài học
Nâng cấp lên tài khoản VIP để tải tài liệu và dùng thêm được nhiều tiện ích khác
Từ khóa tìm kiếm:
Bài giảng điện tử Hóa học 11 KNTT, Tải giáo án Powerpoint Hóa học 11 kết nối bài 5: Ammonia, Muối ammonium, giáo án powerpoint Hóa học 11 kết nối tri thức bài 5: Ammonia, Muối ammonium
