Tải giáo án Powerpoint Hóa học 11 KNTT bài 1: Khái niệm về cân bằng hoá học
Tải bài giảng điện tử powerpoint Hóa học 11 Kết nối tri thức bài 1: Khái niệm về cân bằng hoá học. Bài học được thiết kể đẹp mắt, nội dung giảng dạy hay nhiều trò chơi và video phong phú thu hút học sinh tập trung nắm bắt kiến thức quan trong. Giáo án tải về chỉnh sửa được. Kéo xuống để xem chi tiết
Rõ nét về file powerpoint trình chiếu. => Xem thêm
CHÀO MỪNG CÁC EM ĐẾN VỚI BÀI HỌC MỚI!
KHỞI ĐỘNG
Phản ứng hóa học là quá trình biến đổi các chất đầu thành sản phẩm.
Tuy nhiên, có nhiều phản ứng, các chất sản phẩm sinh ra lại có thể phản ứng với nhau tạo thành chất đầu.
Đối với những phản ứng thế này, làm thế nào để thu được nhiều sản phẩm hơn và làm tăng hiệu suất phản ứng ?
CHƯƠNG 1. CÂN BẰNG HÓA HỌC
BÀI 1: KHÁI NIỆM VỀ CÂN BẰNG HÓA HỌC
NỘI DUNG BÀI HỌC
Phản ứng một chiều và phản ứng thuận nghịch
Cân bằng hóa học
Các yếu tố ảnh hưởng đến sự chuyển dịch cân bằng hóa học
- PHẢN ỨNG MỘT CHIỀU VÀ PHẢN ỨNG THUẬN NGHỊCH
- Phản ứng một chiều
Hình ảnh phản ứng đốt cháy khí methane hoặc đốt cháy than.
CH4 + 2O2 CO2 + 2H2O (1)
Đặc điểm của phản ứng (1):
Các chất sản phẩm không phản ứng được với nhau để tạo thành các chất đầu.
Phản ứng một chiều
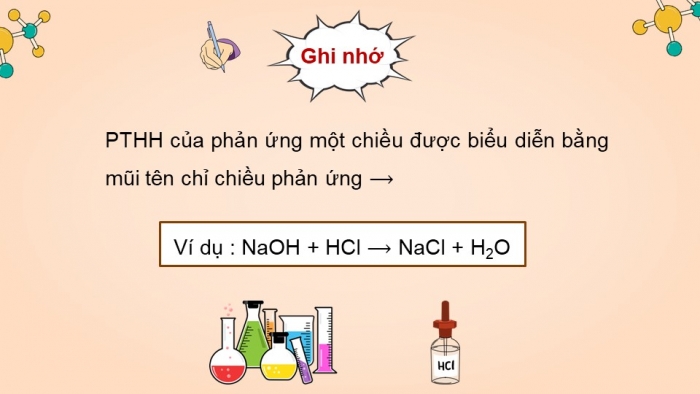
Ghi nhớ
Phản ứng một chiều là phản ứng chỉ xảy ra một chiều từ chất phản ứng tạo thành chất sản phẩm.
Các chất sản phẩm không phản ứng lại được với nhau tạo thành chất đầu.
PTHH của phản ứng một chiều được biểu diễn bằng mũi tên chỉ chiều phản ứng ⟶
Ví dụ : NaOH + HCl NaCl + H2O
Vậy có phản ứng nào mà các chất sản phẩm lại phản ứng được với nhau để tạo thành chất đầu không?
- Phản ứng thuận nghịch
Xét 2 thí nghiệm cùng thực hiện ở 445oC, trong bình kín dung tích 10 lít.
Thí nghiệm 1
|
Ban đầu 1 mol khí H2 1 mol khí I2 |
445oC, bình kín |
Sau phản ứng 0,2 mol khí H2 0,2 mol khí I2 1,6 mol khí HI |
Thí nghiệm 2
|
Ban đầu 2 mol khí HI |
445oC, bình kín |
Sau phản ứng 0,2 mol khí H2 0,2 mol khí I2 1,6 mol khí HI |
Hoạt động mục I.2 SGK trang 6 – 7:
- a) Viết phương trình hóa học của các phản ứng xảy ra trong thí nghiệm 1 và thí nghiệm 2.
- b) Trong cả hai thí nghiệm trên, dù thời gian phản ứng kéo dài bao lâu thì các chất đầu đều còn lại sau phản ứng. Giải thích.
Trả lời
- a) PTHH:
- Thí nghiệm 1: H2(g) + I2(g) 2HI(g)
- Thí nghiệm 2: 2HI(g) H2(g) + I2(g)
b)
- Ở thí nghiệm 1: khí H2 tác dụng với I2 tạo thành HI, đồng thời lại xảy ra phản ứng HI phân hủy tạo thành I2 và H2 nên dù thời gian phản ứng kéo dài bao lâu thì sau phản ứng các chất đầu H2, I2 vẫn còn.
- Ở thí nghiệm 2 : khí HI phân hủy tạo thành H2 và I2, đồng thời lại xảy ra phản ứng khi H2 và I2 tạo thành HI nên dù thời gian phản ứng kéo dài bao lâu thì sau phản ứng chất đầu HI vẫn còn.
KẾT LUẬN
- Phản ứng thuận nghịch là phản ứng xảy ra theo hai chiều ngược nhau trong cùng điều kiện.
- PTHH của phản ứng hai chiều được biểu diễn bằng hai nửa mũi tên ngược chiều nhau . Chiều từ trái sang phải là chiều phản ứng thuận, chiều từ phải sang trái là chiều phản ứng nghịch.
Ví dụ: 3O2 2O3
Trả lời CH1, CH2 mục I.2 SGK trang 7 - 8:
- Quá trình hình thành hang động, thạch nhũ là một ví dụ điển hình về phản ứng thuận nghịch trong tự nhiên.
Nước có chứa CO2 chảy qua đá vôi, bào mòn đá tạo thành Ca(HCO3)2 (phản ứng thuận) góp phần hình thành các hang động. Hợp chất Ca(HCO3)2 trong nước lại bị phân hủy tạo ra CO2 và CaCO3 (phản ứng nghịch), hình thành các thạch nhũ, măng đá, cột đá.
Viết phương trình hóa học của các phản ứng xảy ra trong hai quá trình trên.
CaCO3(s) + H2O(l) + CO2(aq) Ca(HCO3)2(aq)
Hình ảnh một số thạch nhũ, hang động
- Phản ứng xảy ra khi cho khí Cl2 tác dụng với nước là một phản ứng thuận nghịch. Viết phương trình hóa học của phản ứng, xác định phản ứng thuận, phản ứng nghịch.
- PTHH của phản ứng: Cl2 + H2O HCl + HClO
- Phản ứng thuận: Cl2 + H2O HCl + HClO
- Phản ứng nghịch: HCl + HClO Cl2 + H2O
Sfs
TỔNG KẾT
|
|
Phản ứng một chiều |
Phản ứng thuận nghịch |
|
Chiều phản ứng |
Chỉ xảy ra một chiều. |
Xảy ra theo hai chiều trái ngược nhau. |
|
Các chất sản phẩm |
Không phản ứng lại được với nhau tạo thành chất đầu. |
• Các chất sản phẩm phản ứng được với nhau để tạo thành chất đầu. • Dù chất đầu là chất phản ứng của phản ứng thuận hay nghịch thì cuối cùng đều thu được các chất giống nhau. |
|
|
Phản ứng một chiều |
Phản ứng thuận nghịch |
|
Biểu diễn PTHH |
||
|
Phản ứng xảy ra |
Hoàn toàn |
Không hoàn toàn |
|
Ví dụ |
2Mg + O2 2MgO Na2CO3 + 2HCl 2NaCl + CO2 + H2O |
2SO2 + O2 2SO3 CH3COOH + C2H5OH CH3COOC2H5 + H2O |
CÂN BẰNG HÓA HỌC
Hình ảnh về file sile, ppt trình chiếu











.....
=> Còn nữa.... Files tải về, sẽ có đầy đủ nội dung bài học
Nâng cấp lên tài khoản VIP để tải tài liệu và dùng thêm được nhiều tiện ích khác
Từ khóa tìm kiếm:
Bài giảng điện tử Hóa học 11 KNTT, Tải giáo án Powerpoint Hóa học 11 kết nối bài 1: Khái niệm về cân bằng hoá, giáo án powerpoint Hóa học 11 kết nối tri thức bài 1: Khái niệm về cân bằng hoá
