Giải chuyên đề học tập Hoá học 10 CTST bài 7: Hoá học về phản ứng cháy, nổ
Dưới đây là phần hướng dẫn giải chi tiết cụ thể cho bộ chuyên đè học tập hoá học 10 Chân trời sáng tạo bài 7: Hoá học về phản ứng cháy, nổ. Lời giải đưa ra ngắn gọn, cụ thể sẽ giúp ích cho em các em học tập ôn luyên kiến thức tốt, hình thành cho học sinh phương pháp tự học, tư duy năng động sáng tạo. Kéo xuống để tham khảo
1. BIẾN THIÊN ENTHALPY (∆rH°) CỦA MỘT SỐ PHẢN ỨNG CHÁY, NỔ
Câu hỏi 1. Dựa vào dữ liệu bảng 7.1 và 7.2, em hãy tính biến thiên enthalpy của phản ứng đốt cháy 1 mol ethanol và 1 mol khí gas
Câu hỏi 2. Tính biến thiên ethanol của phản ứng đốt cháy 1 mol octane (C8H18, chất có trong xăng) và 1 mol methane (thành phần chính của khí thiên nhiên). Dự đoán mức độ mãnh liệt của các phản ứng này.
Câu hỏi 1.
Biến thiên enthalpy của phản ứng đốt cháy 1 mol ethanol
PTHH: C2H5OH + 3O2 → 2CO2 + 3H2O
$\Delta _{r}H_{298}^{o}$ = 2$\Delta _{f}H_{298}^{o}$(CO2) + 3$\Delta _{f}H_{298}^{o}$ (H2O) - $\Delta _{f}H_{298}^{o}$ (C2H5OH) - 3 $\Delta _{f}H_{298}^{o}$(O2)
= 2.(-393,5) + 3.(-241,826) - (-277,63) - 3.0 = - 1234,848 (kJ/mol) < 0.
Vậy phản ứng toả nhiệt
Biến thiên enthalpy của phản ứng đốt cháy 1 mol khí gas
- Biến thiên enthalpy của phản ứng đốt cháy 1 mol propane
PTHH: C3H8 + 5O2 → 3CO2 + 4H2O
$\Delta _{r}H_{298}^{o}$ = 8Eb(C - H) + 2Eb(C - C) + 5Eb (O = O) - 3.2Eb(C = O) - 4.2Eb(O - H)
= 8.413 + 2.347 + 5.498 - 6.745 - 8.467 = -1718 (kJ/mol)
- Biến thiên enthalpy của phản ứng đốt cháy 1 mol butane
PTHH: C4H10 + $\frac{13}{2}$O2 → 4CO2 + 5H2O
$\Delta _{r}H_{298}^{o}$ = 10Eb(C - H) + 3Eb(C - C) + 6,5Eb (O = O) - 4.2Eb(C = O) - 5.2Eb(O - H)
= 10.413 + 3.347 + 6,5.498 - 8.745 - 10.467 = -2 222 (kJ/mol)
- Biến thiên enthalpy của phản ứng đốt cháy 1 mol khí gas
$\Delta _{r}H_{298}^{o}$ = 0,4.$\Delta _{r}H_{298}^{o}$ (C3H8) + 0,6. $\Delta _{r}H_{298}^{o}$ (C4H10) = 0,4.(-1718) + 0,6. (-2 222) = -2 020,4 (kJ/mol) < 0.
Vậy phản ứng toả nhiệt
Câu hỏi 2
Biến thiên enthalpy của phản ứng đốt cháy 1 mol octane
PTHH: C8H18 + $\frac{25}{2}$O2 → 8CO2 + 9H2O
$\Delta _{r}H_{298}^{o}$ = 18Eb(C - H) + 7Eb(C - C) + 12,5Eb(O = O) - 8.2Eb(C = O) -9.2Eb(O - H)
= 18.413 + 7.347 + 12,5.498 - 16.745 - 18.467 = - 4 238 (kJ/mol)
Biến thiên enthalpy của phản ứng đốt cháy 1 mol methane
PTHH: CH4 + 2O2 → CO2 + 2H2O
$\Delta _{r}H_{298}^{o}$ = 4Eb(C - H) + 2Eb(O = O) - 2Eb(C = O) - 2.2Eb(O - H)
= 4.413 + 2.498 - 2.745 - 4.467 = - 710(kJ/mol)
Phản ứng đốt cháy 1 mol octane xảy ra mãnh liệt hơn đốt cháy 1 mol methane
2. TỐC ĐỘ PHẢN ỨNG CHÁY
Câu hỏi 3. Ở điều kiện thường (298K) oxygen chiếm khoảng 20,9% theo thể tích trong không khí tương đương với áp suất 0,209 atm. Tính nồng độ mol/L của oxygen trong không khí
Câu hỏi 4. Khi thể tích khí oxygen giảm có 15% thể tích không khí thì nồng độ mol/lít của oxygen là bao nhiêu?
Câu hỏi 5. Hãy cho biết tốc độ phản ứng cháy của than đá tăng hay giảm bao nhiêu lần khi thành phần phần trăm theo thể tích của oxygen trong không khí giảm từ 20,9% xuống 15%
Câu hỏi 6. Giả sử một căn phòng có thành phần phần trăm theo thể tích của oxygen trong không khí là 17%. Tốc độ "phản ứng hô hấp" của người ở trong phòng tăng hay giảm bao nhiêu lần so với ở ngoài phòng? Biết rằng oxygen chiếm khoảng 20,9% theo thể tích của không khí.
Câu hỏi 3.
$C_{O_{2}}=\frac{0,209}{0,082.298}=8,55.10^{-3}$M
Câu hỏi 4.
$C_{O_{2}}=\frac{0,15.8,55.10^{-3}}{0,209}=6,13.10^{-3}$M
Câu hỏi 5.
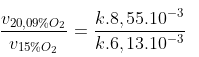 ≈ 1,4
≈ 1,4
Tốc độ phản ứng cháy của than đá giảm 1,4 lần
Câu hỏi 6.
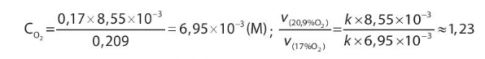
Tốc độ phản ứng hô hấp giảm 1,23 lần
3. NGUYÊN TẮC CHỮA CHÁY
Câu hỏi 7. Nêu những yếu tố ảnh hưởng đến tốc độ phản ứng cháy từ đó hãy nêu một số biện pháp dập tắt đám cháy
Câu hỏi 8. Hãy cho ví dụ về một số chất cháy thuộc từng loại đám cháy trong bảng 7.3
Câu hỏi 9 Vì sao trong một số trường hợp không dùng được nước để dập để chữa cháy (cháy xăng, dầu,...)
Câu hỏi vận dụng
Giải thích tại sao đám cháy có mặt các kim loại hoạt động mạnh như kim loại kiềm, kiềm thổ và nhôm không sử dụng được nước, CO2, cát (thành phần chính là khí SiO2), bọt chữa cháy (hỗn hợp không khí, nước và chất hoạt động bề mặt) để dập tắt đám cháy?
Câu hỏi 7:
Các yếu tố chính ảnh hưởng đến tốc độ phản ứng cháy: chất cháy, chất oxi hoá, nguồn nhiệt. Bản chất và trạng thái của chất cháy có ảnh hưởng rất lớn đến tốc độ cháy. Chất cháy rất phong phú, có thể ở dạng rắn, lỏng hoặc khí, dạng cục hay dạng bột như than, gỗ, tre nứa, xăng, dầu, khí methane, hydrogen, khí carbon monooxide,... Nguồn nhiệt cũng có nhiều dạng như ngọn lửa trần, tia lửa điện, hồ quang điện, tia lửa sinh ra do ma sát, do chập điện,...
Một số phương pháp dập tắt đám cháy:
- Phương pháp làm lạnh: Làm giảm nhiệt độ của phản ứng cháy hoặc làm cho nhiệt độ của vật chảy xuống thấp hơn nhiệt độ bắt cháy.
- Phương pháp cách li: Ngăn cản chất cháy tiếp xúc với chất oxi hoá.
- Phương pháp giảm nồng độ: Làm giảm nồng độ các chất tham gia cháy.
Câu hỏi 8:
Loại đám cháy | Chất cháy | Ví dụ |
Loại A | Đám cháy các chất rắn ( thông thường là các chất hữu cơ ) khi cháy thường kèm theo sự tạo ra than hồng. | Gỗ, giấy, lụa, nhựa, vải, rác,.. |
Loại B | Đám cháy các chất lỏng và chất rắn hoá lỏng. | Xăng, dầu, acetone,... |
Loại C | Đám cháy các chất khí | Propane, khí thiên nhiên, methane, butane, hydrogen,... |
Loại D | Đám cháy các kim loại. | Titanium, potassium, magnesium, aluminium,... |
Loại F | Đám cháy dầu và mỡ của động vật hay thực vật trong các thiết bị nấu nướng. | Dầu ăn, chất béo từ thực phẩm,.. |
Câu hỏi 9.
- Xăng, dầu không tan trong nước và nhẹ hơn nước nên nổi lên trên mặt nước khiến cho đám cháy càng lan rộng hơn, gây hậu quả nghiêm trọng.
- Một số kim loại như sodium, potassium,... là những kim loại phản ứng với nước nên không thể dùng nước để dập tắt những đám cháy này.
Câu hỏi vận dụng
- Một số kim loại như sodium, potassium,... là những kim loại phản ứng với nước nên không thể dùng nước để dập tắt những đám cháy này.
- Đám cháy magnesium hay các kim loại khác như sodium, potassium,... sẽ cháy bốc cháy dữ dội hơn khi có mặt CO2 hoặc cát do xảy ra phản ứng hoá học.
BÀI TẬP
1. Tốc độ phản ứng cháy phụ thuộc nồng độ oxygen. Khi nồng độ Oxygen giảm
thì tốc độ phản ứng cháy thay đổi như thế nào?
2. Tốc độ phản ứng hô hấp phụ thuộc nồng độ oxygen. Khi nồng độ oxygen tăng thì tốc đệ “phản ứng hô hấp” thay đổi như thế nào?
3. Không khí trên đỉnh ngọn núi cao rất loãng. Điều này có thể gây ảnh hưởng xấu đến những người leo núi. Vì vậy, những nhà leo núi luôn trang bị bình dưỡng khi khi họ leo lên những đỉnh núi cao. Giả sử không khí trên đỉnh núi đó có 16% oxvpen theo thể tích. Tốc độ “phản ứng hô hấp” tăng hay giảm bao nhiều lấn so với nơi mà không khí có 20,9% oxygen theo thể tích?
4. Hãy kể tên mội số chất có thể sử dụng để dập tắt đám cháy khi xảy ra hoả hoạn ở
a) xưởng gỗ. b) trạm xăng, dầu.
5. Trong một đám cháy do xăng, dầu, người ta có thể dùng một chiếc chăn thấm ướt hoặc cát để đập tắt đám cháy. Giải thích tại sao có thể làm như vậy.
1. Khi nồng độ Oxygen giảm thì tốc độ phản ứng cháy giảm
2. Khi nồng độ oxygen tăng thì tốc đệ “phản ứng hô hấp” tăng.
3.
$C_{O_{2}}=\frac{8,55.10^{-3}.0,16}{0,209}=6,55.10^{-3}$M
![]() ≈ 1,3
≈ 1,3
Tốc độ phản ứng hô hấp giảm 1,3 lần
4.
a) Có thể sử dụng chất chữa cháy: nước, CO2, dạng bọt hoặc dạng bột khô.
b) Có thế sử dụng chất chữa cháy: CO2, dạng bọt hoặc dạng bột khô.
5. Mục đích để cách li ngọn lửa với oxygen trong không khí.
