Giải chuyên đề học tập Hoá học 10 CTST bài 9: Thực hành thí nghiệm hoá học ảo
Dưới đây là phần hướng dẫn giải chi tiết cụ thể cho bộ chuyên đè học tập hoá học 10 Chân trời sáng tạo bài 9: Thực hành thí nghiệm hoá học ảo. Lời giải đưa ra ngắn gọn, cụ thể sẽ giúp ích cho em các em học tập ôn luyên kiến thức tốt, hình thành cho học sinh phương pháp tự học, tư duy năng động sáng tạo. Kéo xuống để tham khảo
1. GIỚI THIỆU VỀ PHẦN MỀN THÍ NGHIỆM HOÁ HỌC ẢO
2. THỰC HÀNH THÍ NGHIỆM HOÁ HỌC ẢO BẰNG PHẦM MỀN YENKA
Câu hỏi 1. Từ giao diện của phần mềm (Hình 9.1), nêu những thành phần chính của các vùng trên giao diện phần mềm. Kho các bài thí nghiệm (open – online hay open – local) có vai trò gì cho người sử dụng?
Câu hỏi 2. Tìm hiểu cách sử dụng các thanh công cụ trong phần mềm Yenka.
Câu hỏi 3. Từ các bước sử dụng thẻ Open – local, hãy thực hiện mô phỏng thí nghiệm “Định nghĩa tốc độ phản ứng" (Definition of reaction rate) trong mục “Tốc độ phản ứng" (Reaction Rates).
Câu hỏi luyện tập
Sử dụng thẻ Open – local để mô phỏng thí nghiệm “Acid and base”. Phân tích và lí giải kết quả của thí nghiệm.
Câu hỏi 4. Từ kết quả thí nghiệm “Surface area and rate” hãy cho biết:
a) Mục đích sử dụng các quả bóng có màu khác nhau trong thí nghiệm?
b) Tốc độ thoát khí ở ống nghiệm nào nhanh nhất, ở ống nghiệm nào chậm nhất?
c) Diện tích bề mặt ảnh hưởng như thế nào đến tốc độ phản ứng?
Câu hỏi 5. Chọn hoá chất, dụng cụ và thực hiện thí nghiệm điều chế khí sulfur dioxide từ sulfur và oxygen.
Câu hỏi luyện tập Sử dụng thẻ New để mô phỏng thí nghiệm copper (II) oxide tác dụng với 10 mL dung dịch hydrochloric acid 1 M. Nêu hiện tượng và viết phương trình hoá học của phản ứng giữa các chất.
Câu hỏi 1.
Phần 1: New: Sử dụng hoá chất, thiết bị và dụng cụ để tự thiết kế thí nghiệm.
Phần 2: Open – online: Kho các bài thí nghiệm mở trực tuyến.
Phần 3: Open – local: Kho các bài thí nghiệm đã được chuẩn bị sẵn có hướng dẫn.
Câu hỏi 2.
- Tính năng chính của phòng thí nghiệm ảo Yenka
- Công nghệ truyền thông và máy tính (Computing): Giới thiệu lập trình theo cách thức mới, hấp dẫn hơn, cho phép người dùng điều khiển nhân vật hoạt hình 3D bằng cách sử dụng lệnh sơ đồ đơn giản. Toán học (Mathematics): Cho phép tạo mô hình toán học 3D một cách dễ dàng để chứng minh các số 1 thống kê, xác suất, hình học và toạ độ.
- Khoa học (Sciene): Phòng thí nghiệm ảo của Yenka vô cùng lí tưởng cho các bài giảng khoa học, chứng minh các khái niệm đầy an toàn, mô phỏng chính xác.
- Công nghệ (Technology): Cho phép kiểm tra các dự án điện tử, các chương trình PIC, PICAE và tạo giao diện PCB 3D.
- Sau khi chọn tính năng, chọn môn học (Chemistry). Chọn: New; Open – online hay Open – local. Tìm thí nghiệm đã được chuẩn bị sẵn có hướng dẫn hay tự thiết kế thí nghiệm.
Câu hỏi 3
Khởi động.
Mở Kho các bài thí nghiệm có hướng dẫn Open – local.
Chọn Reaction Rates Definition of reaction rate.
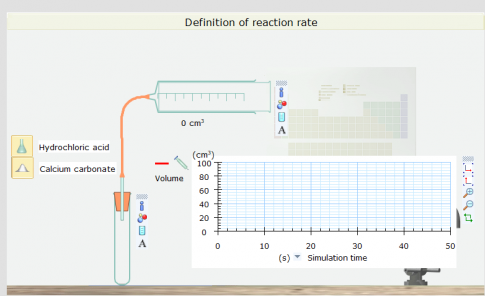
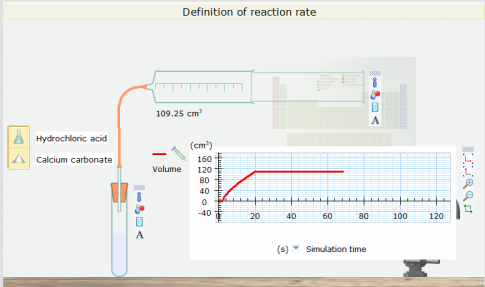
Lấy hoá chất cho vào ống nghiệm. Nếu muốn hiển thị chuyển động các ion, nguyên tử, phân tử chọn vào biểu tượng bên cạnh ống nghiệm phản ứng. Nhấn ![]() để bắt đầu phản ứng. Kết quả như hình dưới
để bắt đầu phản ứng. Kết quả như hình dưới
Trước phản ứng
Sau phản ứng
Câu hỏi luyện tập
Sử dụng thẻ Open – local chọn “Acid and base” và làm theo hướng dẫn ở phía dưới thí nghiệm.
Giải thích: Do khi cho HCl vào NaOH thì xảy ra phản ứng
NaOH + HCl → NaCl + H2O
Câu hỏi 4.
a) Sử dụng các quả bóng có màu khác nhau trong thí nghiệm để dễ phân biệt các ống nghiệm với kích thước hạt khác nhau.
b) Tốc độ thoát khí ở ống nghiệm (1) nhanh nhất kích thước nhỏ nhất, ở ống nghiệm (3) chậm nhất với kích thước lớn nhất.
c) Diện tích bề mặt càng lớn tốc độ phản ứng càng nhanh.
Câu hỏi 5.
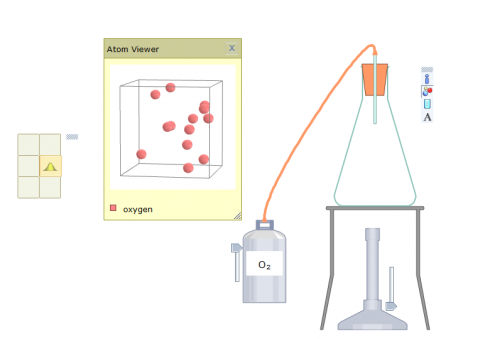
Chọn hoá chất
- Lấy oxygen: Vào Chemicals → Gas → Oxygen
- Lấy sulfur: Vào Chemicals → Miscellaneous → Powders → Sulfur
Chọn dụng cụ:
Giá đỡ và đèn Bunsen: Vào Equipment → Apparatus → Bunsen burner (đèn khí), stand (giá đỡ),
Chọn bình tam giác (bình erlen): Vào Equipment → Glassware → Standard → Erlenmeyer flask
Chọn nút cao su 1 ống dẫn khí: Vào Equipment → Stoppers → Large → One tube
Chọn khay đựng hoá chất: Vào Presentation → Tray
Thực hiện thí nghiệm điều chế khí sulfur dioxide từ sulfur và oxygen.

Câu hỏi luyện tập
Bước 1: Nhấp chuột vào thẻ New, chọn Presentation → rồi kéo ra màn hình làm việc, gõ tên thí nghiệm “Copper (II) oxide tác dụng với dung dịch hydrochloric acid ”. Sau đó chọn (khay để hoá chất, dụng cụ).
Bước 2: Lấy hoá chất
- Chọn copper (II) oxide: Nhấp chuột vào thẻ Chemicals → Metals → Powders & Liquids → copper (II) oxide, rồi kéo vào vùng làm thí nghiệm. Nếu thí nghiệm nhiều hoá chất và dụng cụ nên cho vào khay.
- Chọn dung dịch hydrochloric acid, nhấn vào thẻ Chemicals → acids → hydrochloric acid, thả sang màn hình hoặc vào khay.
- Nhấp vào các thông số về nồng độ và thể tích để điều chỉnh cho phù hợp với thí nghiệm. Chọn nồng độ 1 M và thể tích là 10 cm3.
Bước 3: Lấy dụng cụ
Chọn ống nghiệm: Nhấp chuột vào thẻ Glassware → Standard → Test tube (ống nghiệm).
Chọn nút: Nhấp chuột vào thẻ Equipment → Stoppers → Large → One tube.
Equipment → Apparatus → Bunsen burner (đèn khí), stand (giá đỡ), tap (vòi nước).
Bước 4: Nhấp nút Play / Pause trên thanh công cụ. Cho hydrochloric acid vào ống nghiệm, chọn tiếp copper (II) oxide và kéo vào ống nghiệm đã có acid. Đun bằng đèn khí có giá đỡ.
3. THỰC HÀNH THÍ NGHIỆM HOÁ HỌC ẢO BẰNG PHẦN MỀM PhET
Câu hỏi luyện tập: Thực hành thí nghiệm “Dung dịch acid - base" bằng phần mềm PhET.
a) Hiển thị các dung dịch dưới dạng phân tử hoặc đồ thị.
b) Thực hiện thí nghiệm với các dụng cụ khác nhau được cung cấp trong mô phỏng.
c) Ghi lại kết quả của thí nghiệm.
d) Nhận xét về giá trị pH của dung dịch acid – base.
Câu hỏi luyện tập:
Bước 1: Bấm vào hình tam giác sẽ xuất hiện bảng mức độ thể hiện khác nhau, chọn "Giới thiệu" hay "Dung dịch của tôi".
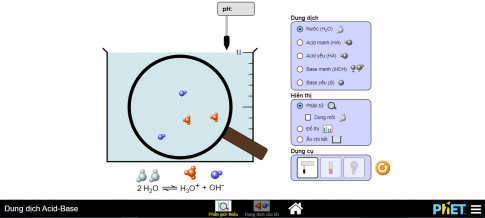

Bước 2: Sau đó hiện màn hình hiển thị thí nghiệm, chọn dung dịch cần đo là acid hay base. Sử dụng pH meter/bảng màu pH để đo pH của dung dịch, ví dụ “Môi trường acid", thay đổi nồng độ dung dịch để thu được các kết quả đo. Quan sát và ghi lại kết quả.

Bước 3: Hiển thị kết quả dưới dạng phân tử hay đồ thị. Thay đổi môi trường base, lặp lại cách đo, ghi kết quả đo được.
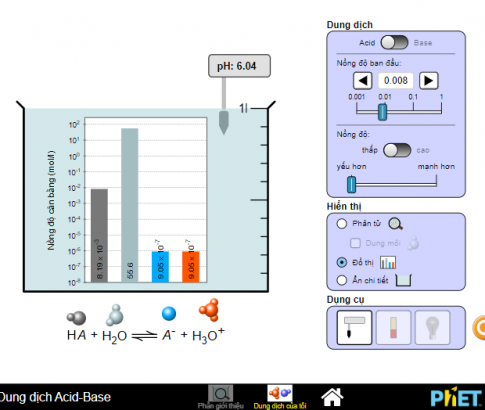
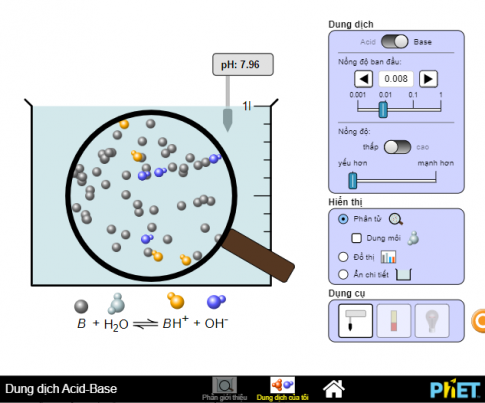
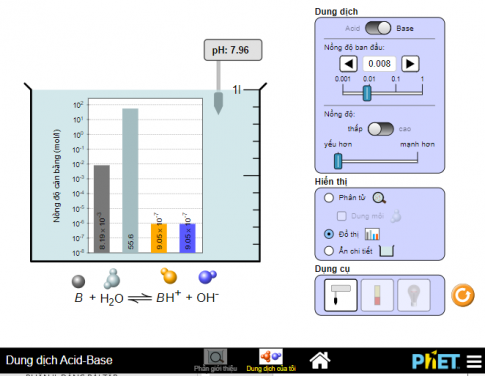
Bước 4: Nhận xét về giá trị pH của dung dịch acid – base. Đưa ra kết luận về giá trị đo được của các dung dịch, sắp xếp theo thứ tự tăng dần giá trị pH. Có thể hiển thị kết quả dưới dạng phân tử hay đồ thị.
BÀI TẬP
1. Sử dụng cửa số Open — local của phẩn mềm Yenka nghiên cứu về mưa acid (theo hình hướng dẫn sau). Rút ra kết luận từ kết quả thí nghiệm.

2. Sử dụng thẻ Open - local của phân mềm Yenka, thực hiện thí nghiệm ảnh hưởng của nhiệt độ lên tốc độ phản ứng “Temperature and rate" Phân tích và lí giải kết quả của thí nghiệm.
3. Hãy thiết kế thí nghiệm (thẻ New): Phân ứng của dung dịch copper (II)chloride 1M (CuCl2) với dụng dịch potassium hydroxide 1M (KOH).
a) Ghi rõ các bước chuẩn bị hoá chất, dụng cụ, cách tiến hành thí nghiệm.
b) Nêu hiện tượng xảy ra vả giải thích.
4. Thực hành thí nghiệm “Hình dạng phân tử” bằng phẩn mềm PhET: Rút ra kết
luận từ kết quả thu được.
1. Sử dụng cửa số Open — local của phẩn mềm Yenka. Chọn "Acids, bases and salts" chọn "acid rain"
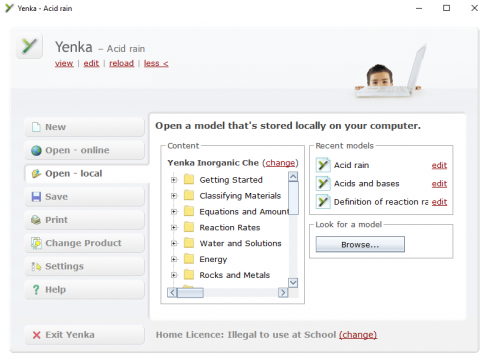
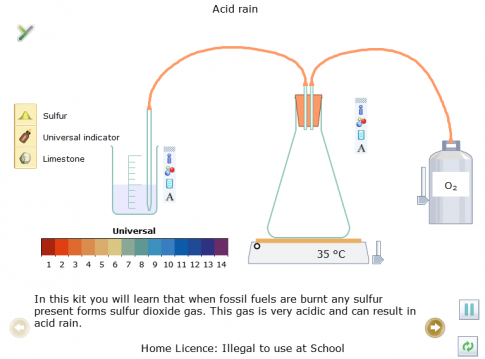
Thực hiện theo hướng dẫn sẽ thu được kết quả là:

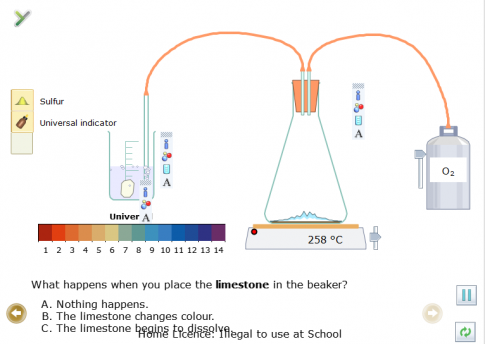
Kết luận: Từ kết quả thí nghiệm: Khi cho S tác dụng với O2 tạo ra SO2, khí SO2 tan trong nước làm quỳ tím hoá đỏ tạo môi trường acid. Khi cho đá vôi vào thì xảy ra hiện tượng đá vôi tan và sủi bọt khí.
2. Sử dụng thẻ Open - local của phân mềm Yenka, chọn Reaction Rates, chọn “Temperature and rate" như hình sau:
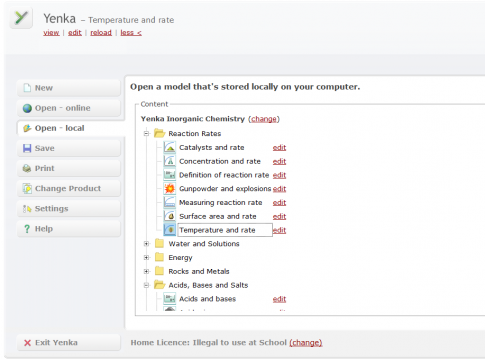
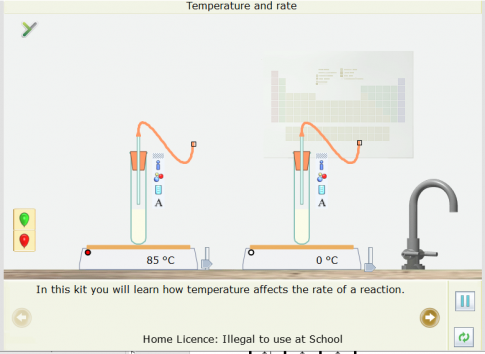
Thực hiện theo hướng dẫn sẽ thu được kết quả là:

Kết luận: Từ kết quả thí nghiệm cho thấy ảnh hưởng của nhiệt độ lên tốc độ phản ứng. Nhiệt độ cao tốc độ phản ứng nhanh hơn.
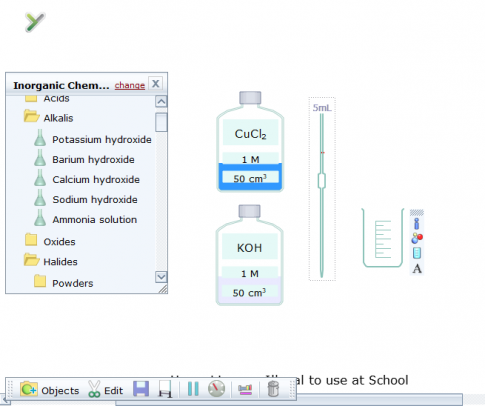
3. Sử dụng thẻ New thực hiện phản ứng của dung dịch copper(Il) chloride 1 M (CuCl2) với dung dịch potassium hydroxide 1 M (KOH).
Chọn hoá chất: Copper(II) chloride 1 M, tiếp tục tìm dung dịch potassium hydroxide 1 M. Kéo ra màn hình hoặc cho vào khay.
Lấy dụng cụ:
Chọn Equiptment › Glassware › Standard › Beaker 50 mL
Chọn Equiptment › Glassware › Measuring› Pipette 5 mL
Cho 5 mL dung dịch CuCl2 vào cốc, cho tiếp 10 mL dung dịch KOH, quan sát hiện tượng xảy ra.
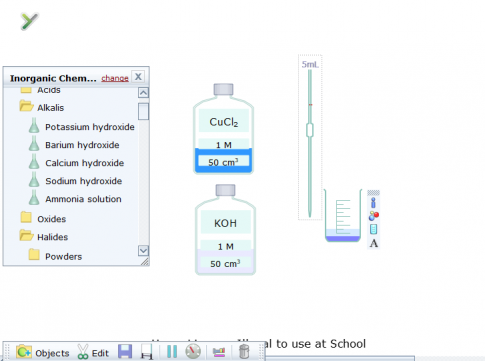
Hiện tượng tạo kết tủa xanh của Cu(OH)2
PTHH: CuCl2 + 2KOH → Cu(OH)2↓ + 2KCl
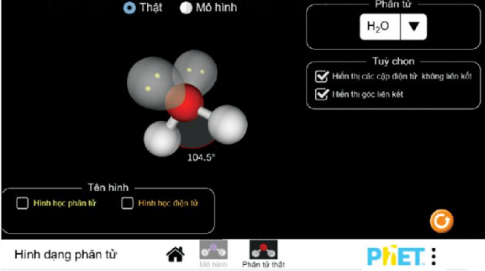
4. Thực hành thí nghiệm “Hình dạng phân tử” bằng phẩn mềm PhET
Bước 1: Bấm vào hình tam giác sẽ xuất hiện bảng mức độ thể hiện khác nhau
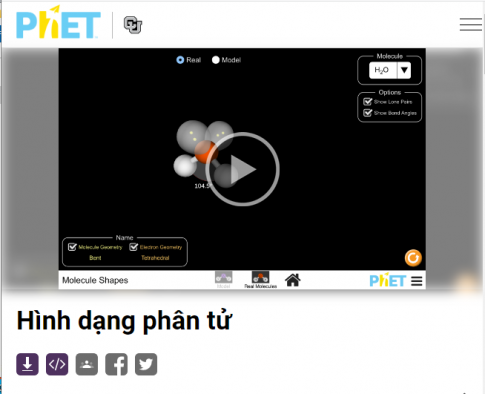
Bước 2: Sau đó hiện màn hình hiển thị thí nghiệm, chọn "Thật" hay "mô hình". Thay đổi phân tử. Quan sát và ghi lại kết quả.

Mô hình

Phân tử thật
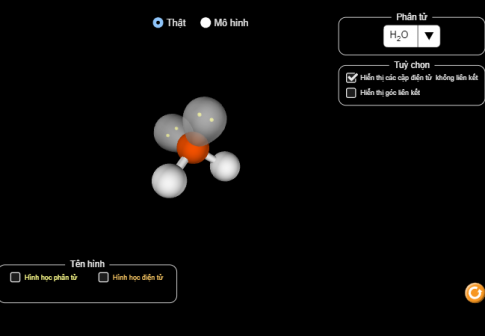
Rút ra kết luận thu được
