Giải chuyên đề học tập Hoá học 10 KNTT bài 1: Liên kết hóa học
Dưới đây là phần hướng dẫn giải chi tiết cụ thể cho bộ chuyên đè học tập hoá học 10 Kết nối tri thức bài 1: Liên kết hóa học. Lời giải đưa ra ngắn gọn, cụ thể sẽ giúp ích cho em các em học tập ôn luyên kiến thức tốt, hình thành cho học sinh phương pháp tự học, tư duy năng động sáng tạo. Kéo xuống để tham khảo
I. CÔNG THỨC CỦA LEWIS
Câu hỏi 1. Công thức Lewis của CS2 là

Câu hỏi 2. Trình bày các bước để viết công thức Lewis của phân tử NH3.
Câu hỏi 3. Viết các công thức Lewis cho mỗi phân tử sau:
a) Cl2; N2.
b) SO2; SO3.
c) H2O; H2S; HOCl.
Câu hỏi 4. Công thức Lewis biểu diễn cấu tạo của NO2 là:
![]()
Câu hỏi 1. Đáp án: B
Viết cấu hình electron xác định được C có 4e hoá trị, S có 6e hoá trị
Bước 1: Tổng số electron hóa trị = 1.4 + 2.6 = 16 electron.
Bước 2:Trong phân tử CS2, nguyên tử C cần 4 electron để đạt octet, nguyên tử S cần 2 electron hóa trị để đạt octet.
Vì vậy, C là nguyên tử trung tâm, còn các nguyên tử S được xếp quanh: S – C – S.
Bước 3: Mỗi nguyên tử S cần 6 electron hóa trị để đạt octet:
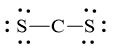
Bước 4: Số electron hóa trị còn lại = 16 – 2.2 – 2.6 = 0
Số electron hóa trị của nguyên tử C là 4 nên đạt octet mỗi nguyên tử S dùng 1 cặp electron hóa trị để tạo liên kết với nguyên tử C.
Công thức Lewis của CS2 là
![]()
Câu hỏi 2.
Bước 1: Tổng số electron hóa trị = 1.5 + 3.1 = 8 electron
Bước 2: Trong phân tử NH3, nguyên tử N cần 3 electron để đạt octet, nguyên tử H cần 1 electron hóa trị để đạt octet.
Vì vậy, N là nguyên tử trung tâm, còn các nguyên tử H được xếp xung quanh
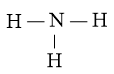
Bước 3: Nguyên tử H đã đạt octet.
Bước 4: Số electron hóa trị còn lại là: 8 – 2.3 = 2
⇒ Chuyển 2 electron còn lại vào nguyên tử N để đạt octet, thu được công thức Lewis của phân tử NH3.

Câu hỏi 3.
a) Công thức Lewis của Cl2 là:
Bước 1: Số electron hóa trị là 2.7 = 14 electron
Bước 2: Trong phân tử Cl2, mỗi nguyên tử Cl cần 1 electron để đạt octet.
Cl – Cl
Bước 3: Mỗi nguyên tử Cl cần 6 electron hóa trị để đạt octet:
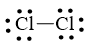
Bước 4: Số electron hóa trị còn lại là: 14 – 6.2 – 2.1 = 0
Cả hai nguyên tử Cl đều đạt octet nên công thức Lewis của Cl2 là:
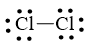
Công thức Lewis của N2 là:
Bước 1: Số electron hóa trị là 5.2 = 10 electron
Bước 2: Trong phân tử N2, mỗi nguyên tử N cần 3 electron để đạt octet.
N – N
Bước 3: Mỗi nguyên tử N cần 6 electron hóa trị để đạt octet:
![]()
Bước 4: Số electron hóa trị còn lại là: 10 – 6.2 – 2.1 = - 4
- Số electron hóa trị của nguyên tử N là 5, nên để đạt octet mỗi nguyên tử N sẽ góp chung 3 electron hóa trị để tạo liên kết với nhau.
Công thức Lewis của phân tử N2 là:
: N ≡ N :
b)
Công thức Lewis của SO2 là:
Bước 1: Số electron hóa trị là 1.6 + 2.6 = 18 electron.
Bước 2: Trong phân tử SO2, nguyên tử S cần 2 electron để đạt octet, nguyên tử O cần 2 electron hóa trị để đạt octet. Vì vậy, S là nguyên tử trung tâm, còn nguyên tử O được xếp xung quanh: O – S – O.
Bước 3: Hoàn thiện octet cho nguyên tử O: ![]()
Bước 4: Số electron hóa trị còn lại: 18 – 2.2 – 2.6 = 2
Sử dụng 2 electron này để tạo octet cho S.
Nguyên tử S có 4 electron hóa trị nên 1 nguyên tử O sẽ dùng 1 cặp electron để tạo liên kết với S và nguyên tử S còn 1 đôi electron chưa tham gia liên kết.
Công thức Lewis của SO2 là: 
Viết công thức Lewis của SO3
Bước 1: S có 6 electron hóa trị, O có 6 electron hóa trị. Trong phân tử SO3, có 1 nguyên tử S và 3 nguyên tử O
⇒ Tổng số electron hóa trị = 1.6 + 3.6 = 24 electron
Bước 2: Vẽ khung tạo bởi các nguyên tử liên kết với nhau: 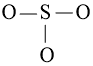
Bước 3: Mỗi nguyên tử O cần 6 electron để đạt octet.
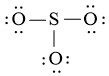
Bước 4: Số electron hóa trị còn lại là: 24 – 2.3 – 6.3 = 0
Tuy nhiên S chưa đủ octet nên ta chuyển 1 cặp electron của nguyên tử O tạo thành cặp electron dùng chung.
chung.
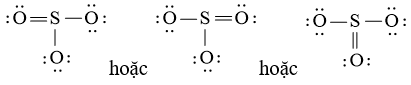

c)
Công thức Lewis của H2O là:
Bước 1: Tổng số electron hóa trị là 1.2 + 1.6 = 8
Bước 2: Trong phân tử H2O, nguyên tử O cần 2 electron để đạt octet, nguyên tử H cần 1 electron hóa trị để đạt octet. Vì vậy, O là nguyên tử trung tâm, còn các nguyên tử H được xếp xung quanh. H – O – H.
Bước 3: Nguyên tử H đã đạt octet.
Bước 4: Số electron hóa trị còn lại là: 8 – 2.2 = 4
Nguyên tử O có 4 electron hóa trị nên sẽ chuyển 4 electron còn lại cho O để nguyên tử O đạt octet.
Công thức Lewis của H2O là: ![]()
Công thức Lewis của H2S là:
Bước 1: Tổng số electron hóa trị của phân tử = 1.2 + 1.6 = 8 electron
Bước 2: Trong phân tử H2S, nguyên tử S cần 2 electron để đạt octet, nguyên tử H cần 1 electron để đạt octet. Vì vậy, nguyên tử S là nguyên tử trung tâm, còn 2 nguyên tử H được xếp xung quanh: H – S – H
Bước 3: 2 nguyên tử H đã đạt octet.
Bước 4: Số electron hóa trị còn lại = 8 – 2.2 = 4
Nguyên tử S có 4 electron hóa trị nên để đạt octet thì chuyển 4 electron còn lại cho nguyên tử S.
Công thức Lewis của H2S là: ![]()

Công thức Lewis của HOCl là:
Bước 1. Tổng số electron hóa trị của phân tử = 1.1 + 1.6 + 1.7 = 14 electron.
Bước 2. Trong phân tử HOCl, nguyên tử Cl cần 1 electron để đạt octet, nguyên tử O cần 2 electron để đạt octet, nguyên tử H cần 1 electron để đạt octet. Vì vậy, O là nguyên tử trung tâm, nguyên tử H và Cl được xếp xung quang: H – O – Cl
Bước 3. Nguyên tử H đã đạt octet, nguyên tử Cl cần 7 electron hóa trị để đạt octet:
![]()
Bước 4: Số electron hóa trị còn lại: 14 – 2.2 – 1.6 = 4
Số electron hóa trị của O là 4, nên chuyển 4 electron còn lại vào nguyên tử O.
Công thức Lewis của HOCl là
![]()
Câu hỏi 4. Đáp án: C
Bước 1: Tổng số electron hóa trị trong phân tử = 1.5 + 2.6 = 17 electron
Bước 2: Trong phân tử NO2, nguyên tử N cần 3 electron để đạt octet, nguyên tử O cần 2 electron hóa trị để đạt octet. Vì vậy, N là nguyên tử trung tâm, còn các nguyên tử O được xếp xung quanh: O – N – O
Bước 3: Mỗi nguyên tử O cần 6 electron hóa trị để đạt octet:
![]()

Bước 4: Số electron hóa trị còn lại là 17 – 6.2 – 2.2 = 1
Mà nguyên tử N chưa đạt octet nên 1 nguyên tử O sẽ dùng 1 cặp electron hóa trị để tạo liên kết với nguyên tử N và trên nguyên tử N vẫn còn 1 electron chưa tham gia liên kết.
Công thức Lewis của NO2 là: 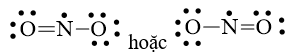

II. CẤU TRÚC HÌNH HỌC CỦA MỘT SỐ PHÂN TỬ
Câu hỏi 5. Công thức của PCl3 theo mô hình VSEPR là
A. AX3. B. AXE2. C. AX3E. D. AX2E.
Câu hỏi 6. Viết công thức của một số phân tử sau theo mô hình VSEPR: CCl4, H2S, CO2, SO3 và PH3. Nêu số cặp electron hóa trị liên kết và chưa liên kết trong mỗi phân tử.
Câu hỏi 7. Viết công thức theo mô hình VSEPR và cho biết dạng hình học của phân tử OF2. Phân tử này có phân cực không?
Câu hỏi 8: Dạng hình học của ion NH4+ là
A. tứ diện đều. B. tháp tam giác.
C. tam giác phẳng. D. đường thẳng.
Câu hỏi 9. Dự đoán dạng hình học của một số phân tử sau: CO2, CS2, BF3, SCl2.
Câu hỏi 5. Đáp án: C
Công thức Lewis của PCl3 là:
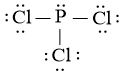
Theo mô hình VSEPR, công thức phân tử của PCl3 có dạng AX3E vì:
+ Có 3 nguyên tử Cl liên kết với nguyên tử trung tâm P.
+ Có nguyên tử P (nguyên tử trung tâm) có 1 cặp electron hóa trị chưa tham gia liên kết.
Câu hỏi 6.
Công thức Lewis của CCl4 là:
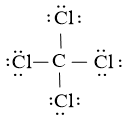
Phân tử CCl4: có 4 nguyên tử Cl liên kết với nguyên tử trung tâm C và nguyên tử C (nguyên tử trung tâm) không còn cặp electron hóa trị chưa tham gia liên kết
⇒ Công thức theo mô hình VSEPR: AX4.
⇒ Số cặp electron hóa trị liên kết là 4.
Công thức Lewis của H2S là: ![]()
Phân tử H2S: có 2 nguyên tử H liên kết với nguyên tử trung tâm S và nguyên tử S còn 2 cặp electron hóa trị chưa tham gia liên kết
⇒ Công thức theo mô hình VSEPR: AX2E2.
⇒ Số cặp electron hóa trị liên kết là 2.
Công thức Lewis của CO2 là: ![]()
Phân tử CO2: có 2 nguyên tử O liên kết với nguyên tử trung tâm C và nguyên tử C không còn cặp electron hóa trị chưa liên kết
⇒ Công thức theo mô hình VSEPR: AX2.
⇒ Số cặp electron hóa trị liên kết là 4.
Công thức Lewis của SO3 là:
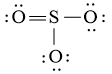
Phân tử SO3: có 3 nguyên tử O liên kết với nguyên tử trung tâm S và nguyên tử S không còn cặp electron hóa trị chưa liên kết
⇒ Công thức theo mô hình VSEPR: AX3.
⇒ Số cặp electron hóa trị liên kết là 6.
Công thức Lewis của PH3 là:
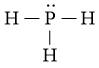
Phân tử PH3: có 3 nguyên tử H liên kết với nguyên tử trung tâm P và nguyên tử P còn 1 cặp electron hóa trị chưa tham gia liên kết
⇒ Công thức theo mô hình VSEPR: AX3E.
⇒ Số cặp electron hóa trị liên kết là 3.
Câu hỏi 7. Công thức Lewis của OF2 là: ![]()
- Trong phân tử OF2 có 2 nguyên tử F liên kết với nguyên tử trung tâm O và xung quanh nguyên tử trung tâm O có 2 cặp electron chưa liên kết
⇒ Công thức theo mô hình VSEPR: AX2E2.
- Do cặp electron chưa tham gia liên kết chiếm khoảng không gian lớn hơn so với cặp electron liên kết, tương tác đẩy giữa cặp electron chưa liên kết lớn hơn tương tác đẩy giữa cặp electron liên kết, nên góc liên kết FOF thực tế bằng 104,5o, nhỏ hơn góc hóa trị theo lí thuyết (109,5o)
⇒ Phân tử có dạng góc.
⇒ Phân tử OF2 phân cực do phân tử dạng góc và liên kết O – F phân cực.
Câu hỏi 8. Đáp án: A

Ion NH4+ gồm có 4 nguyên tử H liên kết với nguyên tử trung tâm N bằng 4 cặp electron liên kết (theo mô hình VSEPR có dạng AX4), chiếm bốn khu vực tích điện âm đẩy nhau để góc hóa trị lớn nhất là 109,5o. Bốn cặp electron được phân bố hướng về 4 đỉnh của tứ diện, phân tử có cấu trúc tứ diện, tâm tứ diện là nguyên tử trung tâm N.
Câu hỏi 9.
Công thức Lewis của CO2
![]()
⇒ Phân tử CO2 theo mô hình VSEPR có dạng AX2 nên phân tử có cấu trúc thẳng.
- Công thức Lewis của CS2 là
![]()
Phân tử CS2 theo mô hình VSEPR có dạng AX2 nên phân tử có cấu trúc thẳng.
Công thức Lewis của BF3 là
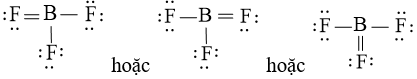
Phân tử BF3 theo mô hình VSEPR có dạng AX3 nên phân tử có cấu trúc tam giác phẳng.
Công thức Lewis của SCl2 là:
![]()
Phân tử SCl2 theo mô hình VSEPR có dạng AX2E2 nên phân tử có dạng góc.
III. SỰ LAI HOÁ ORBITAL NGUYÊN TỬ
Câu hỏi 10. Các nguyên tử carbon (1), (2), (3) trong hình bên ở những trạng thái lai hóa nào?
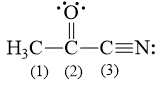
Câu hỏi 11. Mô tả sự tạo thành các phân tử sau theo khái niệm lai hóa orbital.
a) Phân tử BeH2. b) Phân tử SO2. c) Phân tử NH3.
Câu hỏi 12. Cho các phân tử NCl3, SO3, CO2.
a) Nguyên tử trung tâm trong các phân tử trên ở trạng thái lai hóa nào?
b) Phân tử nào không phân cực, phân tử nào phân cực? Vì sao?
Câu hỏi 10.
C (1) lai hóa sp3 bởi vì C này chỉ tạo liên kết đơn.
C (2) lai hóa sp2 bởi vì C này có tạo liên kết đôi.
C (3) lai hóa sp bởi vì C này có tạo liên kết ba.
Câu hỏi 11.
a) Phân tử BeH2.
Cấu hình electron hóa trị của Be: 2s2.
Trong nguyên tử Be, một AO 2s tổ hợp với 1 AO 2p, tạo ra hai AO lai hóa sp.
Hai AO lai hóa sp của nguyên tử Be xen phủ với hai AO s của hai nguyên tử H tạo thành hai liên kết σ giữa Be – H. Nguyên tử trung tâm Be không còn electron chưa liên kết nên hai AO lai hóa đẩy nhau với lực lớn nhất tạo góc 180o. Trong phân tử BeH2, nguyên tử Be còn hai AO – p không lai hóa và là AO trống.
H - Be - H
b) Phân tử SO2.
Cấu hình electron hóa trị của S: 3s23p4.
Trong nguyên tử S, một AO 3s lai hóa với hai AO p, tạo ra ba AO lai hóa sp2.
Nguyên tử S dùng AO lai hóa sp2 thứ nhất (chứa 1 e độc thân) xen phủ với AO p của một trong hai nguyên tử O tạo liên kết σ và dùng AO không lai hóa chứa 1 e độc thân xen phủ với AO p của chính nguyên tử O đó tạo ra liên kết π. Nguyên tử S dùng AO lai hóa sp2 thứ hai chứa cặp e tạo liên kết cho – nhận với AO trống của nguyên tử O còn lại và nguyên tử S còn AO lai hóa sp2 thứ ba chứa cặp e không liên kết. Do cặp e không liên kết đẩy mạnh hơn hai cặp e liên kết nên phân tử SO2 có dạng góc (chữ V)
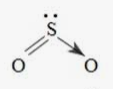
c) Phân tử NH3.
Công thức Lewis của NH3 là:
⇒ Công thức VSEPR của NH3 là: AX3E1
Từ công thức VSEPR dự đoán được trạng thái lai hóa của nguyên tử N trong phân tử NH3 là sp3.
Cấu hình electron của N là: 1s22s22p3
1 AO 2s tổ hợp với 3 AO 2p tạo 4 AO lai hóa sp3
Ba AO lai hóa sp3 (chứa electron độc thân) của nguyên tử N xen phủ với AO 1s của 3 nguyên tử H, tạo va liên kết σ, hướng về ba đỉnh của hình tứ diện. Nguyên tử N còn 1 AO lai hóa sp3 chứa một cặp electron chưa liên kết nằm hướng về đỉnh còn lại của tứ diện. Tuy nhiên cặp electron chưa liên kết này đẩy mạnh hơn nên làm góc liên kết giảm, nên nhỏ hơn 109,5o

Câu hỏi 12.
a) Trong phân tử NCl3, nguyên tử N là nguyên tử trung tâm lai hóa sp3.
Trong phân tử SO3, nguyên tử S là nguyên tử trung tâm, lai hóa sp2.
Trong phân tử CO2, nguyên tử C là nguyên tử trung tâm, lai hóa sp.
b) Phân tử NCl3, SO3 phân cực vì liên kết giữa nguyên tử trung tâm với nguyên tử còn lại là liên kết phân cực.
Phân tử CO2 không phân cực vì hai liên kết phân cực C = O bị triệt tiêu do phân tử có dạng đường thẳng.
