Tải giáo án PowerPoint Hóa học 10 CTST bài 14: Tính biến thiên enthalpy của phản ứng hóa học (3 tiết)
Tải giáo án trình chiếu hay còn gọi là giáo án powerpoint Hóa học 10 bộ sách Chân trời sáng tạo bài 14: Tính biến thiên enthalpy của phản ứng hóa học (3 tiết). Soạn giáo án được thiết kế với tiêu chí đẹp mắt, hiện đại kết hợp nhiều hoạt động, trò chơi, video học tập thú vị. Phương pháp giảng dạy mới kết hợp nhiều dạng bài tập phong phú sẽ giúp học sinh nắm chắc kiến thức trọng tâm bài học. Kéo xuống để tham khảo
Rõ nét về file powerpoint trình chiếu. => Xem thêm
BÀI 14. TÍNH BIẾN THIÊN ENTHALPY CỦA PHẢN ỨNG HÓA HỌC (3 tiết)
- KHỞI ĐỘNG
Câu hỏi: Methane cháy tỏa nhiệt lớn nên được dùng làm nhiên liệu. Khi trộn methane và oxygen với tỉ lệ thích hợp sẽ tạo ra hôn hợp nổ.
Hình ảnh (1.Khởi động)
Biến thiên enthalpy của phản ứng trên được tính toán dựa trên các giá trị nào?
Đáp án
Biến thiên enthalpy của phản ứng cháy của methane có thể được tính theo hai cách:
- Cách 1: Dựa vào nhiệt tạo thành chuẩn của các chất:
- Cách 2: Dựa vào năng lượng liên kết của các chất.
- NỘI DUNG BÀI HỌC
- Xác định biến thiên enthalpy của phản ứng dựa vào năng lượng liên kết
- Xác định biến thiên enthalpy của phản ứng dựa vào enthalpy tạo thành
III. PHẦN TRIỂN KHAI KIẾN THỨC
- Xác định biến thiên enthalpy của phản ứng dựa vào năng lượng liên kết
- Tính biến thiên enthalpy của phản ứng dựa vào năng lượng liên kết
Hoạt động nhóm 4: Em hãy đọc thông tin mục 1 SGK và trả lời câu hỏi:
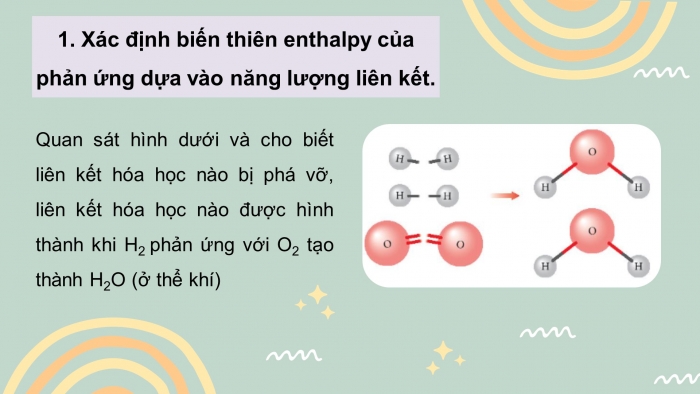
CH1. Quan sát hình 14.1 cho biết liên kết hóa học nào bị phá vỡ, liên kết hóa học nào được hình thành khi H2 phản ứng với O2 tạo thành H2O (ở thể khí)?
Hình ảnh (2.Hình 14.1)
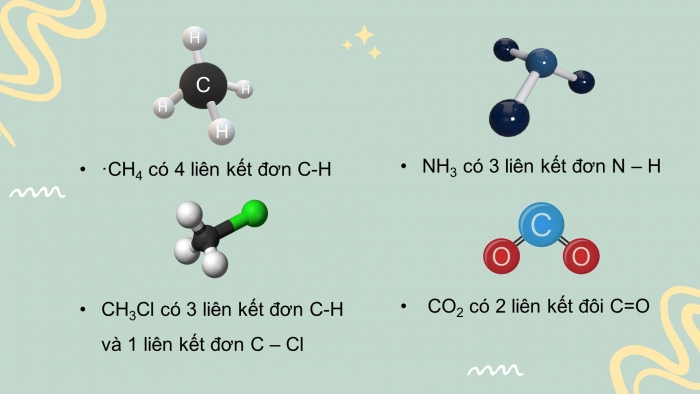
CH2. Để tính biến thiên enthalpy của phản ứng dựa vào năng lượng liên kết phải viết được công thức cấu tạo của tất cả các chấy trong phản ứng để xác định số lượng và loại liên kết. Xác định số lượng mỗi loại liên kết trong các phân tử sau: CH4, CH3Cl, NH3, CO2.
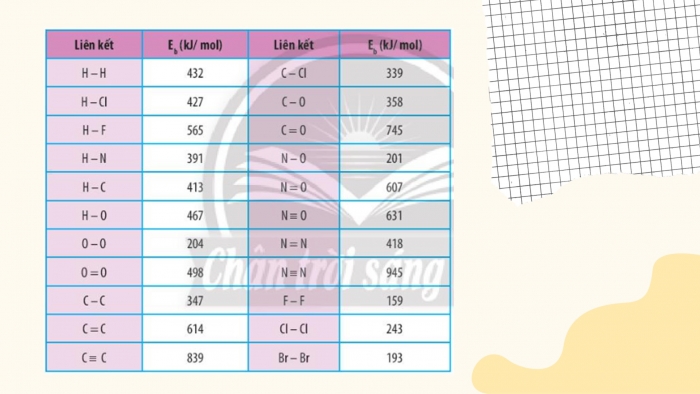
CH3. Dựa vào năng lượng liên kết ở Bảng 14.1, tính biến thiên enthalpy của phản ứng và giải thích vì sao nitrogen chỉ phản ứng với oxygen ở nhiệt độ cao hoặc có tia lửa điện để tạo thành nitrogen monoxide .
Luyện tập 1. Xác định của phản ứng sau dựa vào giá trị ở bảng 14.1:
Hãy cho biết phản ứng trên tỏa nhiệt hay thu nhiệt?
Hình ảnh (3.Bảng 14.1)
Trả lời
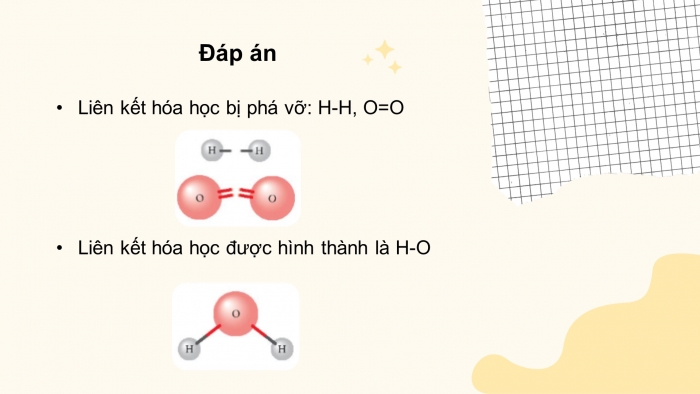
CH1.
+ Liên kết hóa học bị phá vỡ: H-H, O=O
+ Liên kết hóa học được hình thành là HCl
CH2.
- CH4 có 4 liên kết đơn C-H
- CH3Cl có 3 liên kết đơn C-H và 1 liên kết đơn C – Cl
- NH3 có 3 liên kết đơn N – H
- CO2 có 2 liên kết đôi C=O
CH3.
Ta thấy để phá vỡ 1 liên kết và 1 liên kết để hình thành 2 liên kết N-O cần cung cấp nhiệt lượng lớn (229kJ).
→ Cần thực hiện ở nhiệt độ cao hoặc có tia lửa điện thì phản ứng mới xảy ra.
Luyện tập 1.
→ Phản ứng tỏa nhiệt.
à Kết luận
= -
Với , : tổng năng lượng liên kết trong phân tử chất đầu và sản phẩm của phản ứng.
Luyện tập 2. Tính của hai phản ứng sau:
Liên hệ giữa giá trị với độ bền của và giải thích, biết phân tử gồm 1 liên kết đôi O=O và 1 liên kết đơn O-O.
Trả lời
Dựa vào kết quả tính toán: O2→ 2O và 3O2 có < 0 → tồn tại O2 → O2 là trạng thái bền của nguyên tố oxygen.
- Xác định biến thiên enthalpy của phản ứng dựa vào enthalpy tạo thành
- Tính biến thiên enthalpy của phản ứng dựa vào enthalpy tạo thành
Hoạt động nhóm 4: Em hãy nghiên cứu thông tin SGK và trả lời câu hỏi:
CH4. Giá trị biến thiên enthalpy của phản ứng có liên quan tới hệ số các chất trong phương trình nhiệt hóa học không? Giá trị enthalpy tạo thành thường được đo ở điều kiện nào?
Luyện tập. Dựa vào giá trị enthalpy tạo thành ở Bảng 13.1, hãy tính giá trị của các phản ứng sau:
Trả lời
- Giá trị biến thiên enthalpy của phản ứng liên quan hệ số các chất trong phương trình nhiệt hóa học.
- Khi tính giá trị biến thiên enthalpy cần nhân hệ số tỉ lượng với enthalpy tạo thành của các chất tương ứng.
- Giá trị enthalpy tạo thành thường được đo ở điều kiện chuẩn: Áp suất 1 bar (đối với chất khí), nồng độ 1 mol/L (đối với chất tan trong dung dịch) và thường chọn nhiệt độ 25oC (hay 298K).
Luyện tập.
(1)
Hình ảnh về file sile, ppt trình chiếu








.....
=> Còn nữa.... Files tải về, sẽ có đầy đủ nội dung bài học
Nâng cấp lên tài khoản VIP để tải tài liệu và dùng thêm được nhiều tiện ích khác
Từ khóa tìm kiếm:
Giáo án Powerpoint Hóa học 10 chân trời sáng tạo, giáo án điện tử Hóa học 10 CTST bài 14: Tính biến thiên enthalpy của phản, giáo án trình chiếu Hóa học 10 chân trời bài 14: Tính biến thiên enthalpy của phản
