Tải giáo án PowerPoint Hóa học 10 CTST bài 8: Quy tắc octet
Tải giáo án trình chiếu hay còn gọi là giáo án powerpoint Hóa học 10 bộ sách Chân trời sáng tạo bài 8: Quy tắc octet. Soạn giáo án được thiết kế với tiêu chí đẹp mắt, hiện đại kết hợp nhiều hoạt động, trò chơi, video học tập thú vị. Phương pháp giảng dạy mới kết hợp nhiều dạng bài tập phong phú sẽ giúp học sinh nắm chắc kiến thức trọng tâm bài học. Kéo xuống để tham khảo
Rõ nét về file powerpoint trình chiếu. => Xem thêm
CHÀO MỪNG CÁC EM ĐẾN VỚI BUỔI HỌC HÔM NAY
KHỞI ĐỘNG
Các nguyên tử muốn trở nên bền vững tương tự như nguyên tử khí hiếm sẽ phải “xử lí” lớp vỏ electron ngoài cùng như thế nào?
BÀI 8. QUY TẮC OCTET
NỘI DUNG BÀI HỌC
LIÊN KẾT HOÁ HỌC
QUY TẮC OCTET
LIÊN KẾT HOÁ HỌC
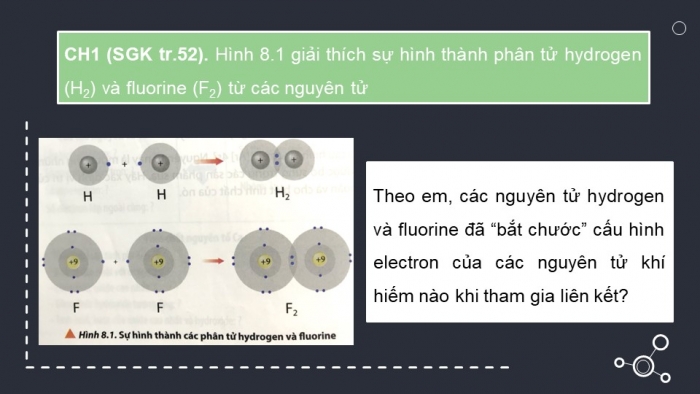
CH1 (SGK tr.52). Hình 8.1 giải thích sự hình thành phân tử hydrogen (H2) và fluorine (F2) từ các nguyên tử
Theo em, các nguyên tử hydrogen và fluorine đã “bắt chước” cấu hình electron của các nguyên tử khí hiếm nào khi tham gia liên kết?
Để hình thành phân tử hydrogen (H2) và phân tử fluorine (F2), các nguyên tử đã bắt chước theo các nguyên tử khí hiếm tương ứng là:
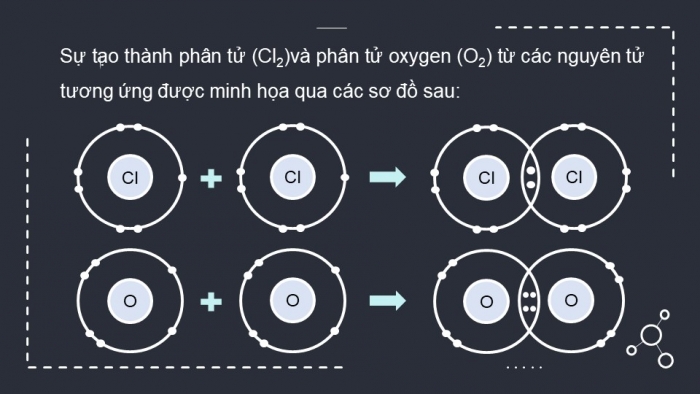
CH2 (SGK tr.52). Sử dụng sơ đồ tương tự như Hình 8.1, hãy giải thích sự tạo thành phân tử chlorine (Cl2) và oxygen (O2) từ các nguyên tử tương ứng.
Sự tạo thành phân tử (Cl2)và phân tử oxygen (O2) từ các nguyên tử tương ứng được minh họa qua các sơ đồ sau:
Phân tử được tạo nên từ các nguyên tử bằng liên kết hoá học.
QUY TẮC OCTET
Hoạt động nhóm. Giải thích cách các nguyên tử H, F và N sử dụng các electron hóa trị khi hình thành nên các phân tử H2, F2 và N2
Trong nguyên tử đang xét:
- Có bao nhiêu electron hóa trị?
- Có xu hướng nhường hay nhận electron bao nhiêu electron để đạt cấu hình khí hiếm gần nhất?
- Trong trường hợp cả hai đều có xu hướng nhận electron thì chúng sẽ cùng góp electron để dùng chung tạo liên kết hóa học. Vậy nguyên tử nguyên tố đang xét sẽ góp thành mấy cặp electron chung?
Phân tử H2: Nguyên tử H có 1e hóa trị
Mỗi nguyên tử H góp chung 1e tạo thành một cặp electron dùng chung
Phân tử F2: Nguyên tử F có 7e hóa trị
Mỗi nguyên tử F góp chung 1e tạo thành một cặp electron dùng chung
Phân tử N2: Nguyên tử N có 5e hóa trị
Mỗi nguyên tử N góp chung 3e tạo thành ba cặp electron dùng chung
Luyện tập (SGK tr.53). Nguyên tử của các nguyên tố hydrogen và fluorine có xu hướng cho đi, nhận thêm hay góp chung các electron hóa trị khi tham gia liên kết hình thành phân tử hydrogen fluoride (HF)?
Nguyên tử H có 1e lớp ngoài cùng
Nguyên tử F có 7e lớp ngoài cùng
Mỗi nguyên tử góp 1 electron tạo thành cặp electron chung
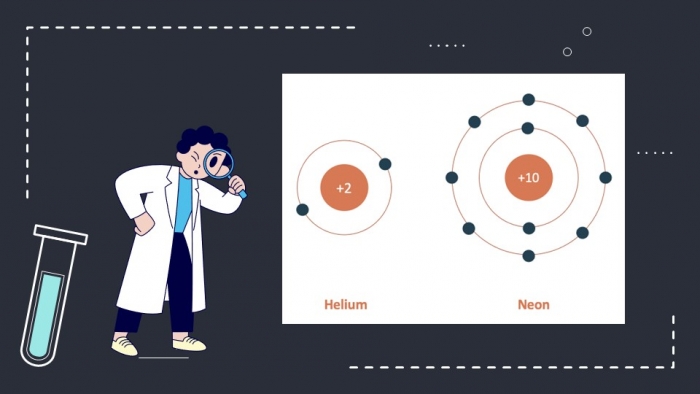
Nguyên tử H, F lần lượt đạt cấu hình bền của helium và neon.
HOẠT ĐỘNG NHÓM
Nhóm 1 + 2: Giải thích cách các nguyên tử sodium và fluorine vận dụng quy tắc octet khi hình thành nên ion sodium và ion fluoride.
Nhóm 3: Tìm thêm các ví dụ về sự hình thành ion dương và ion âm khác.
Nguyên tử Na có 1e lớp ngoài cùng → Dễ nhường 1e để đạt cấu hình bền vững
Phân tử thu được mang điện tích dương là ion sodium, kí hiệu là Na+
Nguyên tử F có 7e lớp ngoài cùng → Khi nhận 1e sẽ đạt cấu hình bền vững
Phân tử thu được mang điện tích dương là ion fluoride, kí hiệu: F-
Ví dụ về sự hình thành một số ion khác:
CH4 (SGK tr.53): Ion sodium và ion fluoride có cấu hình electron của các khi hiếm tương ứng nào?
Ion sodium ion và ion fluorine đều có cấu hình electron của khí hiếm tương xứng neon.
CH5 (SGK tr.54). Trình bày sự hình thành ion lithium. Cho biết ion lithium có cấu hình electron của khí hiếm tương ứng nào?
Nguyên tử Lithium có 1e lớp ngoài cùng
Cho đi 1e để đạt cấu hình electron bền vững
Ion lithium có cấu hình electron của khí hiếm tương ứng helium
Hình ảnh về file sile, ppt trình chiếu







.....
=> Còn nữa.... Files tải về, sẽ có đầy đủ nội dung bài học
Nâng cấp lên tài khoản VIP để tải tài liệu và dùng thêm được nhiều tiện ích khác
Từ khóa tìm kiếm:
Giáo án Powerpoint Hóa học 10 chân trời sáng tạo, giáo án điện tử Hóa học 10 CTST bài 8: Quy tắc octet, giáo án trình chiếu Hóa học 10 chân trời bài 8: Quy tắc octet
