Tải giáo án PowerPoint Hóa học 10 CTST bài 3: Nguyên tố hóa học
Tải giáo án trình chiếu hay còn gọi là giáo án powerpoint Hóa học 10 bộ sách Chân trời sáng tạo bài 3: Nguyên tố hóa học. Soạn giáo án được thiết kế với tiêu chí đẹp mắt, hiện đại kết hợp nhiều hoạt động, trò chơi, video học tập thú vị. Phương pháp giảng dạy mới kết hợp nhiều dạng bài tập phong phú sẽ giúp học sinh nắm chắc kiến thức trọng tâm bài học. Kéo xuống để tham khảo
Rõ nét về file powerpoint trình chiếu. => Xem thêm
CHÀO MỪNG CÁC EM HỌC SINH ĐẾN VỚI BÀI HỌC NGÀY HÔM NAY
Kim cương và than chì có vẻ ngoài khác nhau. Tuy nhiên chúng đề được tạo thành từ một nguyên tố hóa học là nguyên tố carbon (C). Tại sao lại có sự khác biệt lớn như vậy?
BÀI 3. NGUYÊN TỐ HÓA HỌC
NỘI DUNG BÀI HỌC
- Hạt nhân nguyên tử
- Nguyên tố hóa học
- Đồng vị
- Nguyên tử khối và nguyên tử khối trung bình
- Hạt nhân nguyên tử
Tìm hiểu về điện tích hạt nhân
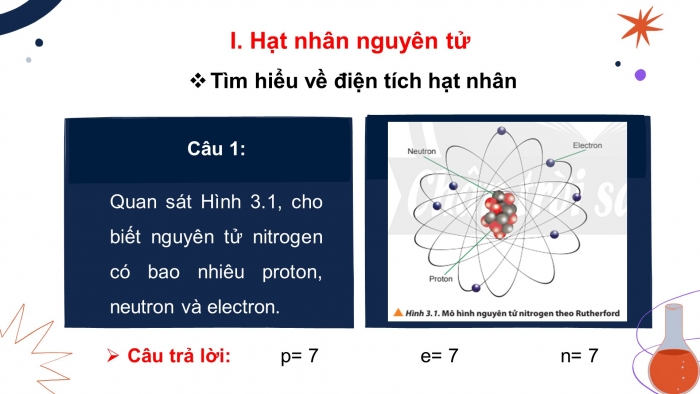
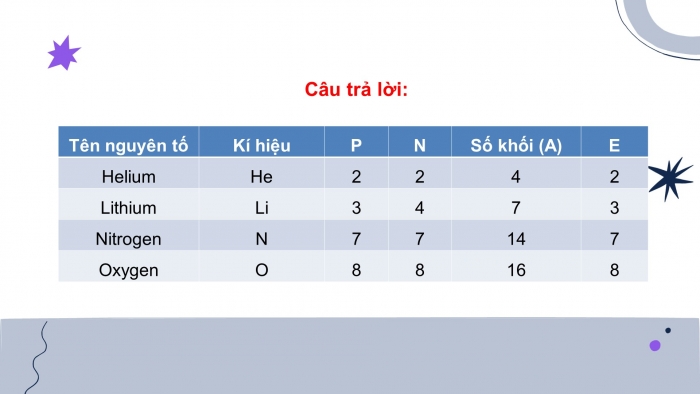
Câu 1: Quan sát Hình 3.1, cho biết nguyên tử nitrogen có bao nhiêu proton, neutron và electron.
- Câu trả lời: p= 7 e= 7 n= 7
Câu 2: Điện tích hạt nhân của nguyên tử nitrogen có giá trị là bao nhiêu?
- Câu trả lời: Điện tích hạt nhân của nguyên tử nitrogen là +7.
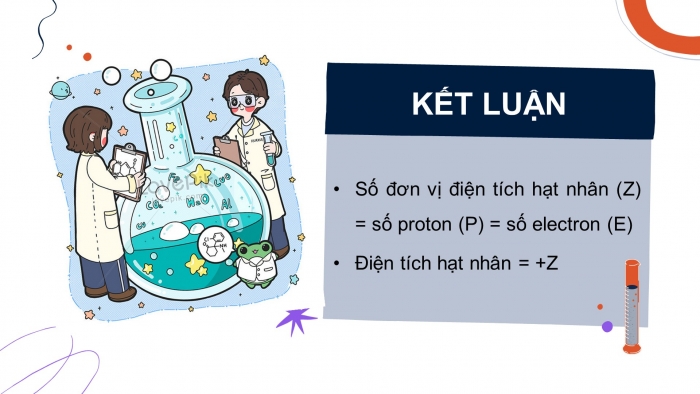
KẾT LUẬN
- Số đơn vị điện tích hạt nhân (Z) = số proton (P) = số electron (E)
- Điện tích hạt nhân = +Z
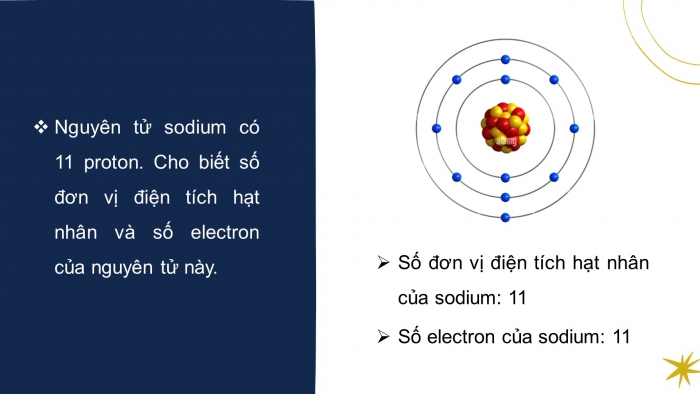
Nguyên tử sodium có 11 proton. Cho biết số đơn vị điện tích hạt nhân và số electron của nguyên tử này.
- Số đơn vị điện tích hạt nhân của sodium: 11
- Số electron của sodium: 11
Tìm hiểu về số khối
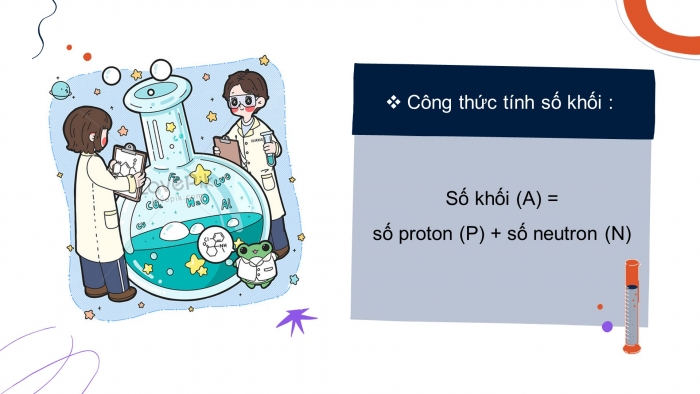
Số khối bằng tổng số hạt proton và số hạt neutron trong hạt nhân, kí hiệu là A
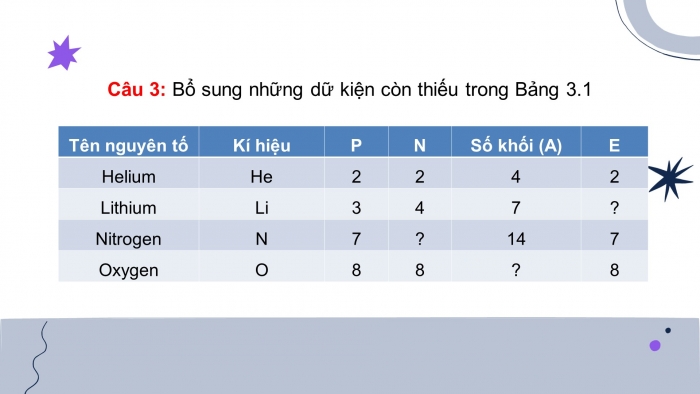
Câu 3: Bổ sung những dữ kiện còn thiếu trong Bảng 3.1
Câu trả lời:
- Công thức tính số khối :
- Số khối (A) =
- số proton (P) + số neutron (N)
- Nguyên tố hóa học
Tìm hiểu về số hiệu nguyên tử
- Nhà vật lí sử dụng một chùm tia electron có năng lượng cao để bắn vào các tấm kim loại khác nhau làm anode và thu được tia X.
- Kết quả: Bước sóng của tia X luôn không đổi với một kim loại nhất định và thay đổi khi thay anode bằng những kim loại khác.
- Điều này chứng tỏ rằng mỗi kim loại khác nhau sẽ có số proton khác nhau.
a, Làm thế nào để phân biệt được từng công dân của nước Việt Nam
- Dùng số chứng minh thư nhân dân hoặc thẻ căn cước công dân.
- b) Làm thế nào để phân biệt được học sinh trong từng lớp, từng trường?
- Dùng số thẻ học sinh
- c) Làm thế nào để phân biệt được các hộ chiếu đi nước ngoài?
- Dùng số hộ chiếu
- d) Làm thế nào để phân biệt được các xe máy?
- Dùng biển số xe
- e) Vậy đại lượng nào đặc trưng cho các nguyên tố, dùng để phân biệt các nguyên tố hóa học với nhau?
- Số hiệu nguyên tử ( số proton)
Số hiệu nguyên tử quy ước bằng gì? Kí hiệu là gì ?
- Số hiệu nguyên tử được quy ước bằng số đơn vị điện tích hạt nhân. Kí hiệu là Z.
Dựa vào số hiệu nguyên tử ta có thể biết được số lượng các loại hạt nào?
- Dựa vào số hiệu nguyên tử ta có thể biết: số proton trong hạt nhân nguyên tử và số electron trong nguyên tử.
KẾT LUẬN
- Số đơn vị điện tích hạt nhân của một nguyên tố được gọi là số hiệu nguyên tử (Z) của một nguyên tố đó.
- Mỗi nguyên tố hóa học có một số hiệu nguyên tử
Câu 4:
Nguyên tố carbon có số hiệu nguyên tử là 6. Xác định điện tích hạt nhân của nguyên tử này.
- Câu trả lời: Điện tích hạt nhân: +6
Tìm hiểu khái niệm nguyên tố hóa học
Câu 5: Quan sát Hình 3.2, cho biết số proton, số neutron, số electron và điện tích hạt nhân của từng loại nguyên tử của nguyên tố hydrogen.
- Nhận xét: 3 nguyên tử của nguyên tố Hydrogen đều có 1 proton
KẾT LUẬN
Nguyên tố hóa học tập hợp những nguyên tử có cùng điện tích hạt nhân
- Tìm hiểu kí hiệu nguyên tử
Các chỉ số đặc trưng như số khối và số hiệu nguyên tử được viết bên trái kí hiệu nguyên tố hóa học. Số khối A được viết phía trên và số hiệu nguyên tử Z ở phía dưới.
- Nêu ý nghĩa của kí hiệu nguyên tử
- Trình bày cách viết tổng quát của kí hiệu nguyên tử
KẾT LUẬN
- Kí hiệu nguyên tử dùng để biểu thị nguyên tử của một số nguyên tố hóa học.
- Cách viết tổng quát:
Câu 6: Kí hiệu nguyên tử cho biết những thông tin nào?
Kí hiệu nguyên tử cho biết:
- Kí hiệu nguyên tố hóa học,
- Số khối nguyên tử và số nguyên tử.
- Số electron trong nguyên tử và tính được số neutron là: N = A – Z
Câu hỏi luyện tập:
- Viết kí hiueej các nguyên tử của nguyên tố hydrogen (Hình 3.2).
- Viết kí hiệu nguyên tử của nguyên tố oxygen. Biết nguyên tử của nguyên tố này có 8 electron và 8 neutron.
a, Kí hiệu nguyên tử các nguyên tố trong hình 3.2 là:
+ Protium: 11H
+ Deterium: 12H
+ Tritium: 13H
b, Kí hiệu nguyên tử oxygen: 8160
- Đồng vị
- Tìm hiểu khái niệm đồng vị
Câu 7: Quan sát Hình 3.2, so sánh điểm giống và khác nhau giữa các loại nguyên tố hydrogen.
Câu trả lời:
- 3 nguyên tử của nguyên tố hydrogen đều có 1 proton và có số khối khác nhau nên số neutron khác nhau.
Hình ảnh về file sile, ppt trình chiếu






.....
=> Còn nữa.... Files tải về, sẽ có đầy đủ nội dung bài học
MỘT VÀI THÔNG TIN
- Giáo án gửi là giáo án bản Powerpoint, dễ dàng chỉnh sửa nếu muôn
- Giáo án làm theo hướng sinh động, nhiều hình ảnh đẹp nhằm tạo sự thích thú cho học sinh
PHÍ GIÁO ÁN:
- Giáo án word: 250k/học kì - 300k/cả năm
- Giáo án Powerpoint: 300k/học kì - 400k/cả năm
- Trọn bộ word + PPT: 400k/học kì - 450k/cả năm
=> Khi đặt sẽ nhận đủ giáo án cả năm ngay vào luôn
CÁCH ĐẶT:
- Bước 1: gửi phí vào tk: 10711017 - Chu Văn Trí - Ngân hàng ACB (QR)
- Bước 2: Click vào đây để nhắn tin Zalo thông báo và nhận giáo án
Từ khóa tìm kiếm:
Giáo án Powerpoint Hóa học 10 chân trời sáng tạo, giáo án điện tử Hóa học 10 CTST bài 3: Nguyên tố hóa học, giáo án trình chiếu Hóa học 10 chân trời bài 3: Nguyên tố hóa học
