Tải giáo án PowerPoint Hóa học 10 Cánh diều bài 15: Ý nghĩa và cách tính biến thiên enthalpy phản ứng hoá học
Tải giáo án trình chiếu hay còn gọi là giáo án powerpoint Hóa học 10 bộ sách Cánh diều bài 15: Ý nghĩa và cách tính biến thiên enthalpy phản ứng hoá học. Soạn giáo án được thiết kế với tiêu chí đẹp mắt, hiện đại kết hợp nhiều hoạt động, trò chơi, video học tập thú vị. Phương pháp giảng dạy mới kết hợp nhiều dạng bài tập phong phú sẽ giúp học sinh nắm chắc kiến thức trọng tâm bài học. Kéo xuống để tham khảo
Rõ nét về file powerpoint trình chiếu. => Xem thêm
BÀI 15. Ý NGHĨA VÀ CÁCH TÍNH BIẾN THIÊN ENTHALPY PHẢN ỨNG HOÁ HỌC
- KHỞI ĐỘNG
Cho hai phản ứng đốt cháy:
- C(s) + O2(g) → CO2(g) ∆rH0298 = -393,5 kJ
- 2Al (s) + O2 (g) → Al2O3(s) ∆rH0298 = -1675,7 kJ
Ở điều kiện chuẩn, cùng với một khối lượng C và Al, chất nào khi cháy tỏa ra nhiều nhiệt hơn?
Đáp án: Al cháy tỏa ra nhiều nhiệt hơn.
- NỘI DUNG BÀI HỌC
- Ý nghĩa về dấu và giá trị của biến thiên enthalpy phản ứng
- Cách tính biến thiên enthalpy phản ứng
III. PHẦN TRIỂN KHAI KIẾN THỨC
- Ý nghĩa về dấu và giá trị của biến thiên enthalpy phản ứng
Em hãy hoàn thành Phiếu học tập số 1:
|
Phiếu học tập số 1 Câu 1: Điền vào dấu chấm sau
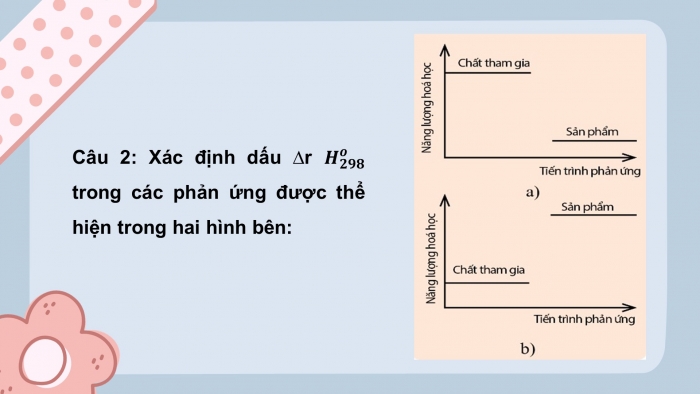
Câu 2: Xác định dấu rHo298 trong các phản ứng được thể hiện trong hai hình dưới đây HÌNH ẢNH
Câu 3: Lập bảng so sánh phản ứng thu nhiệt và phản ứng toả nhiệt
|
Đáp án
Câu 1:
|
Phản ứng toả nhiệt |
Phản ứng thu nhiệt |
|
Lượng nhiệt này gọi là biến thiên enthalpy chuẩn của phản ứng, có giá trị âm rHo298 < 0 Giá trị càng âm, phản ứng toả ra càng nhiều nhiệt |
Lượng nhiệt này gọi là biến thiên enthalpy chuẩn của phản ứng, có giá trị dương rHo298 > 0 Giá trị càng dương, phản ứng thu vào càng nhiều nhiệt |
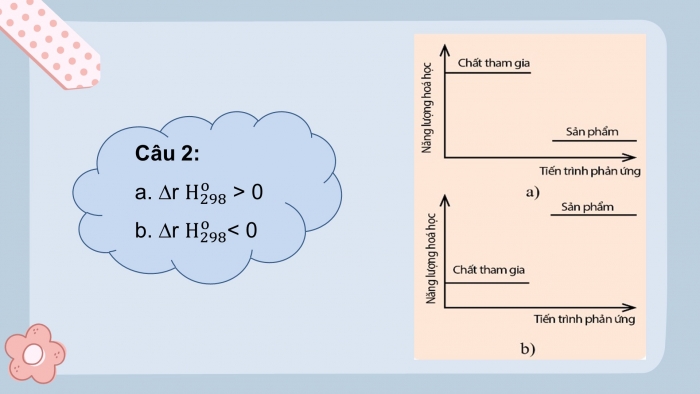
Câu 2:
- rHo298 > 0
- rHo298< 0
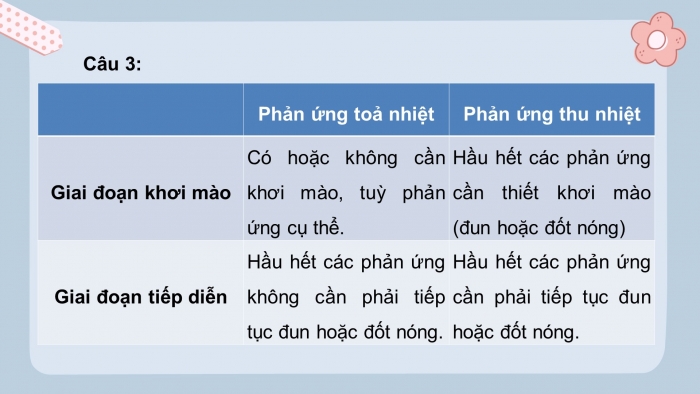
Câu 3:
|
|
Phản ứng toả nhiệt |
Phản ứng thu nhiệt |
|
Giai đoạn khơi mào |
Có hoặc không cần khơi mào, tuỳ phản ứng cụ thể |
Hầu hết các phản ứng cần thiết khơi mào (đun hoặc đốt nóng |
|
Giai đoạn tiếp diễn |
Hầu hết các phản ứng không cần phải tiếp tục đun hoặc đốt nóng |
Hầu hết các phản ứng cần phải tiếp tục đun hoặc đốt nóng |
Em hãy hoàn thành Phiếu học tập số 2
|
Phiếu học tập số 2 Câu 1: Tại sao trong thực tế, người ta sử dụng C2H2 trong đèn xì hàn cắt kim loại mà không dùng CH4. Cho phản ứng đốt cháy methane và acetylene: CH4(g) + 2O2(g) ® CO2(g) + 2H2O(l) ∆rHo298 = –890,36 kJ C2H2(g) + 5/2O2(g) ® 2CO2(g) + H2O(l) ∆rHo298 = –1299,58 k Câu 2: 1) So sánh hai phản ứng sau, phản ứng nào diễn ra thuận lợi hơn? 2Na(s) + O2(g) Na2O(s) ∆rHo298 = – 417,98 KJ (1) 1/2H2(g) + 1/2I2(s) HI(g) ∆rHo298 = +26,48 kJ (2) 2) Cho biết phản ứng: CaCO3(s) → CaO(s) + CO2(g) có ∆rHo298 = 178,29 kJ.(1) - Phản ứng này thuận lợi hay không thuận lợi? - So sánh mức độ thuận lợi diễn ra phản ứng với phản ứng của I2 với H2. 1/2H2(g) + 1/2I2(s) HI(g) ∆rHo298 = +26,48 kJ (2) Câu 3: 1) Phân tử hemoglobin (Hb) trong máu nhận O2 ở phổi để chuyển thành HbO2. Chất này theo máu tới các bộ phận cơ thể, tại đó HbO2 lại chuyển thành Hb và O2 (để cung cấp O2 cho các hoạt động sinh hoá cần thiết trong cơ thể). Nếu trong không khí có lẫn carbon monoxide (CO), cơ thể nhanh chóng bị ngộ độc. Chúng ta có thể lí giải điều này thông qua các số liệu thực nghiệm sau: Hb + O2 HbO2 ∆rHo298 = –33,05 kJ Hb + CO HbCO ∆rHo298 = –47,28 kJ HbO2 + CO HbCO + O2 ∆rHo298 = –14,23 kJ HbCO + O2 HbO2 + CO ∆rHo298 = 14,23 kJ 2) Giải thích vì sao để giữ ấm cơ thể, trước khi lặn, người ta thường uống nước mắm cốt (loại nước mắm chứa nhiều chất đạm) Câu 4: 1)Khi đốt cháy tờ giấy hay đốt lò than ta cần thực hiện giai đoạn khơi mào như thế nào? 2) Vì sao khi nung vôi, người ta phải xếp đá vôi lẫn với than trong lò |
Đáp án
Câu 1: Do lượng nhiệt sinh ra từ C2H2 nhiều gấp 1,5 lần lượng nhiệt sinh ra từ CH4
Câu 2:
(1) Phản ứng 1 diễn ra thuận lợi hơn phản ứng hai do phản ứng 1 là phản ứng toả nhiệt còn phản ứng 2 là phản ứng thu nhiệt
(2)
- Phản ứng 1 không thuận lợi vì phản ứng đó là phản ứng thu nhiệt.
- Phản ứng 2 thuận lợi hơn phản ứng một do ∆rHo298 dương và nhỏ hơn.
Câu 3:
Nếu có nhiều CO thì Hb + CO HbCO xảy ra rất thuận lợi do ∆rHo298 càng âm và phản ứng HbCO + O2 HbO2 + CO càng khó xảy ra do ∆rHo298 dương
- Giải thích vì sao để giữ ấm cơ thể, người ta thường uống nước mắm cốt: Nước mắm cốt có độ đạm cao, chứa rất nhiều acid amin à Các acid amin được hấp thụ nhanh chóng vào cơ thể à Cơ thể có nguyên liệu để tăng sinh nhiệt.
Hình ảnh về file sile, ppt trình chiếu









.....
=> Còn nữa.... Files tải về, sẽ có đầy đủ nội dung bài học
Nâng cấp lên tài khoản VIP để tải tài liệu và dùng thêm được nhiều tiện ích khác
Từ khóa tìm kiếm:
Giáo án Powerpoint Hóa học 10 cánh diều, giáo án điện tử Hóa học 10 cánh diều bài 15: Ý nghĩa và cách tính biến, giáo án trình chiếu Hóa học 10 cánh diều bài 15: Ý nghĩa và cách tính biến
