Tải giáo án Powerpoint Hóa học 10 KNTT bài 10: Quy tắc octet
Tải giáo án trình chiếu hay còn gọi là giáo án powerpoint Hóa học 10 bộ sách Chân trời sáng tạo bài 10: Quy tắc octet. Soạn giáo án được thiết kế với tiêu chí đẹp mắt, hiện đại kết hợp nhiều hoạt động, trò chơi, video học tập thú vị. Phương pháp giảng dạy mới kết hợp nhiều dạng bài tập phong phú sẽ giúp học sinh nắm chắc kiến thức trọng tâm bài học. Kéo xuống để tham khảo
Rõ nét về file powerpoint trình chiếu. => Xem thêm
CHÀO MỪNG CÁC EM ĐẾN VỚI BUỔI HỌC HÔM NAY
KHỞI ĐỘNG
Khi các nguyên tử kết hợp với nhau tạo thành phân tử theo một tỉ lệ xác định, yếu tố nào quyết định tỉ lệ số nguyên tử của mỗi nguyên tố trong phân tử đó?
BÀI 10. QUY TẮC OCTET
NỘI DUNG BÀI HỌC
KHÁI NIỆM LIÊN KẾT HOÁ HỌC
QUY TẮC OCTET
KHÁI NIỆM LIÊN KẾT HOÁ HỌC
Dựa vào SGK và nêu khái niệm liên kết hóa học
Liên kết hóa học là sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn.
Hãy nhắc lại khái niệm về electron hoá trị?
Electron hóa trị là các electron có khả năng tham gia tạo thành liên kết hóa học, thường nằm ở lớp electron ngoài cùng và phân lớp sát ngoài cùng.
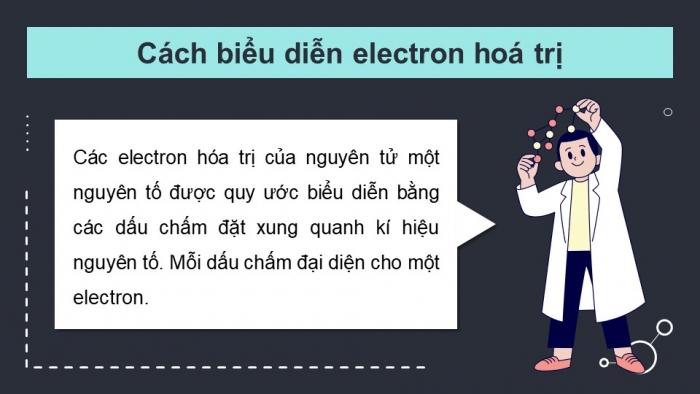
Cách biểu diễn electron hoá trị
Các electron hóa trị của nguyên tử một nguyên tố được quy ước biểu diễn bằng các dấu chấm đặt xung quanh kí hiệu nguyên tố. Mỗi dấu chấm đại diện cho một electron.
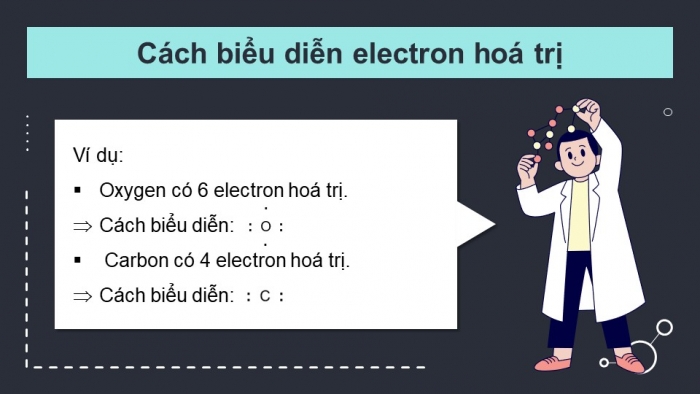
Ví dụ:
- Oxygen có 6 electron hoá trị.
- Cách biểu diễn:
- Carbon có 4 electron hoá trị.
- Cách biểu diễn:
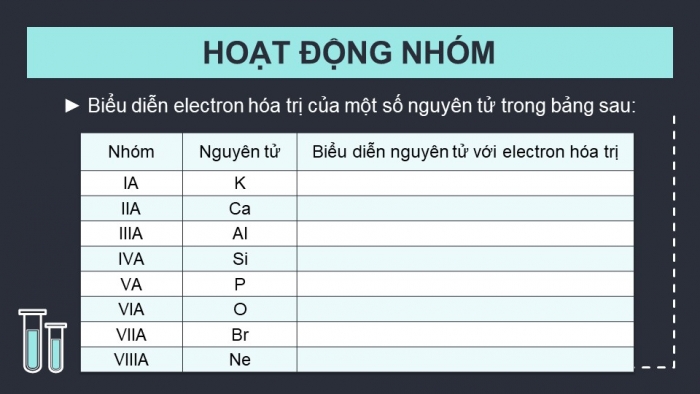
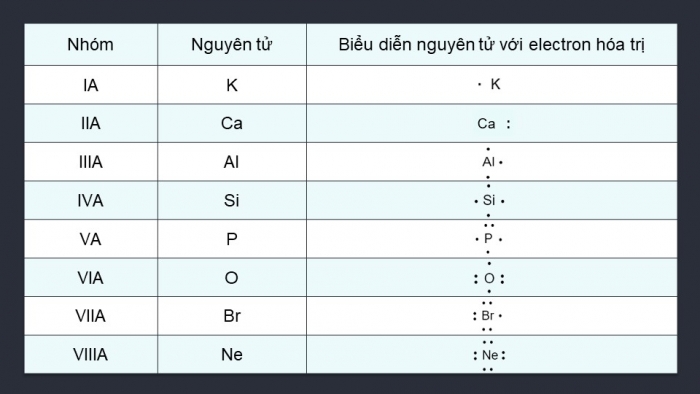
HOẠT ĐỘNG NHÓM
CH2 (SGK tr.49): Để giảm năng lượng, các nguyên tử kết hợp lại thành phân tử theo xu hướng nào?
Để giảm năng lượng, các nguyên tử kết hợp lại theo xu hướng đạt tới cấu hình bền vững của khí hiếm (theo quy tắc octet).
QUY TẮC OCTET
Hoạt động nhóm 4. Trình bày quy tắc octet và lấy ví dụ về sự hình thành liên kết hóa học:
Để đạt cấu hình bền khi tạo liên kết hóa học, các nguyên tử thường có xu hướng như thế nào đối với các electron lớp ngoài cùng?
Quan sát hình dưới đây kết hợp đọc SGK, hãy giải thích sự tạo thành liên kết cộng hóa trị của phân tử Cl2 và liên kết ion của NaF?
Mỗi nhóm hãy đề xuất viết một cấu hình electron hóa trị biểu diễn sự hình thành liên kết.
Quy tắc Octet
Nội dung: Khi hình thành liên kết hóa học, nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững của nguyên tử khí hiếm.
Trong một phân tử khi nào xuất hiện liên kết ion, khi nào xuất hiện liên kết cộng hóa trị?
- Liên kết cộng hóa trị xảy ra khi các nguyên tố liên kết với nhau đều là nguyên tố nhận electron (phi kim).
- Liên kết ion xảy ra khi các nguyên tố nhận electron kết hợp với nguyên tố cho electron (nguyên tố kim loại điển hình liên kết với nguyên tố phi kim điển hình).
LUYỆN TẬP
Hoạt động nhóm đôi.
- Làm các bài tập 3,4 (SGK tr.50).
- CH4 (SGK tr.50): Phosphine là hợp chất hoá học giữa phosphorus với hydrogen, có công thức hóa học là PH3. Đây là chất khí không màu, có mùi tỏi, rất độc, không bền. Phosphine sinh ra khi phân huỷ xác động, thực vật và thường lẫn một lượng nhỏ diphosphine (P2H4) nên nó có thể tự cháy trong không khí ở điều kiện thường và tạo thành khối phát sáng bay lơ lửng (hiện tượng “ma trơi”).
- Vận dụng quy tắc octet để giải thích sự tạo thành liên kết hoá học trong phosphine.
- Nguyên tử P có 5e hóa trị, cần 3e để đạt octet → Góp chung với mỗi nguyên tử H 1e.
- Nguyên tử H có 1e hóa trị, cần 1e để đạt octet → Góp chung với nguyên tử P 1e.
Trong phân tử PH3:
- Nguyên tử P có 8e, giống cấu hình bền của khí hiếm Ne.
- Nguyên tử H có 2e, giống cấu hình bền của khí hiếm He.
- Thoả mãn quy tắc octet
Hình ảnh về file sile, ppt trình chiếu








.....
=> Còn nữa.... Files tải về, sẽ có đầy đủ nội dung bài học
Nâng cấp lên tài khoản VIP để tải tài liệu và dùng thêm được nhiều tiện ích khác
Từ khóa tìm kiếm:
Giáo án Powerpoint Hóa học 10 Kết nối, giáo án điện tử Hóa học 10 KNTT bài 10: Quy tắc octet, giáo án trình chiếu Hóa học 10 kết nối bài 10: Quy tắc octet
