Tải giáo án Powerpoint Hóa học 10 KNTT bài 15: Phản ứng oxi hóa – khử
Tải giáo án trình chiếu hay còn gọi là giáo án powerpoint Hóa học 10 bộ sách Chân trời sáng tạo bài 15: Phản ứng oxi hóa – khử. Soạn giáo án được thiết kế với tiêu chí đẹp mắt, hiện đại kết hợp nhiều hoạt động, trò chơi, video học tập thú vị. Phương pháp giảng dạy mới kết hợp nhiều dạng bài tập phong phú sẽ giúp học sinh nắm chắc kiến thức trọng tâm bài học. Kéo xuống để tham khảo
Rõ nét về file powerpoint trình chiếu. => Xem thêm
BÀI 15: PHẢN ỨNG OXI HÓA – KHỬ
- KHỞI ĐỘNG
Trong lò luyện gang, xảy ra phản ứng oxi hóa khử theo sơ đồ sau:
Fe2O3 + CO Fe + CO2
Hình ảnh
Về bản chất, phản ứng oxi hóa khử là gì? Dựa vào đâu để nhận ra loại phản ứng đó? Làm thế nào để lập phương trình hóa học của phản ứng trên?
- NỘI DUNG BÀI HỌC
- Số oxi hoá
- Chất oxi hoá, chất khử, phản ứng oxi hoá – khử
- Lập phương trình hoá học của phản ứng oxi hoá – khử
- Phản ứng oxi hoá – khử trong thực tiễn
III. PHẦN TRIỂN KHAI KIẾN THỨC
- Số oxi hoá
1.1. Khái niệm
Em hãy đọc đọc SGK và trả lời câu hỏi:
Nêu khái niệm số oxi hóa và cách biểu diễn số oxi hóa.
Khái niệm: Số oxi hóa là điện tích quy ước của nguyên tử trong phân tử khi coi tất cả các electron liên kết đều chuyển hoàn toàn về nguyên tử có độ âm điện lớn hơn.
Cách biểu diễn số oxi hóa: Số oxi hóa được viết ở dạng đại số, dấu viết trước số viết sau.
Ví dụ 1: Xét phân tử NaCl
|
|
Nguyên tử Na nhường 1 electron cho nguyên tử Cl, khi đó, nguyên tử Na trở thành ion dương mang điện tích 1+ ( số oxi hóa của Na là +1) và nguyên tử Cl nhận 1 electron của nguyên tử Na trở thành ion âm mang điện tích 1- ( số oxi hóa của Cl là -1)
Em hãy đọc Ví dụ 2, 3 SGK trang 71 và trả lời câu hỏi:
|
|
Ví dụ 2: Xét phân tử H2O
|
|
Ví dụ 3: Xét phân tử H2
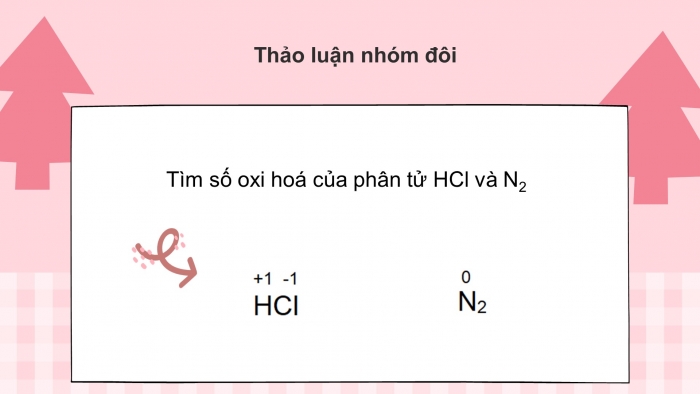
Câu hỏi: Tìm số oxi hoá của phân tử HCl và N2
|
|
|
|
Đáp án:
- Quy tắc xác đinh số oxi hoá
Em hãy đọc sgk và nêu quy tắc 1.
Quy tắc 1: Trong đơn chất, số oxi hóa của nguyên tử bằng 0.
Ví dụ:
Em hãy đọc sgk, quan sát bảng 15.1 và nêu quy tắc 2.
Bảng 15.1. Số oxi hoá thường gặp của một số nguyên tử trong hợp chất
|
Nguyên tử |
Hydrogen |
Oxygen |
Kim loại kiềm (nhóm IA) |
Kim loại kiềm thổ (nhóm IIA) |
Aluminium |
|
Số oxi hoá |
+1 |
-2 |
+1 |
+2 |
+3 |
Quy tắc 2: Trong phân tử hợp chất thông thường, số oxi hóa của hydrogen là +1, của oxygen là -2, các kim loại điển hình có số oxi hóa dương và có giá trị bằng số electron hóa trị.
Em hãy đọc sgk, nêu quy tắc 3 và lấy ví dụ minh hoạ.
Quy tắc 3: Trong hợp chất, tổng số oxi hóa của các nguyên tử trong phân tử bằng 0
|
Ví dụ:
|
Tổng số oxi hoá = (+4).1 + (-2).2 = 0
Em hãy đọc sgk, nêu quy tắc 4 và lấy ví dụ minh hoạ.
Quy tắc 3: Trong ion đơn nguyên tử, số oxi hóa của nguyên tử bằng điện tích ion; trong ion đa nguyên tử, tổng số oxi hóa của các nguyên tử bằng điện tích ion.
Ví dụ: ion Cl- có số oxi hóa là -1
Ion NH4+ :
|
|
Tổng số oxi hoá = (-3) + (+1).4 = +1
Các bước xác định số oxi hóa:
Bước 1: Xác định chất cần xác định là đơn chất, hợp chất hay ion.
- TH1: Là đơn chất → áp dụng quy tắc 1
- TH2: Là hợp chất/ion → bước 2:
Bước 2: Xác định số oxi hóa của các nguyên tố số có số oxi hoá thường không đổi.
Bước 3:Đặt số oxi hoá của nguyên tố còn lại là x, Áp dụng QT3 hoặc QT4 để tìm x.
Em hãy trả lời câu hỏi 1 SGK trang 73
- Xác định số oxi hoá của nguyên tử Fe và S trong các chất sau:
- Fe, FeO, Fe2O3, Fe(OH)3, Fe3O4
- S, H2S, SO2, SO3, H2SO4, Na2SO3
Đáp án:
- a) Số oxi hóa của nguyên tử Fe trong Fe, FeO, Fe2O3, Fe(OH)3, Fe3O4 lần lượt là 0, +2, +3, +3,
- b) Số oxi hóa của nguyên tử S trong S, H2S, SO2, SO3, H2SO4, Na2SO3 lần lượt là 0, -2, +4, +6, +6, +4.
- Chất oxi hoá, chất khử, phản ứng oxi hoá – khử
2.1. Chất oxi hoá, chất khử
Thảo luận nhóm đôi: Tìm hiểu Ví dụ 1, áp dụng viết quá trình khử, oxi hoá của các nguyên tử, phân tử trong Ví dụ 2, 3 SGK trang 73.
|
Ví dụ 1: Đưa mẩu than gỗ nóng đỏ vào bình đựng khí O2, mẩu than cháy sáng.
C + O2 CO2
|
Trong phản ứng trên, nguyên tử C nhường 4 electron, là chất khử; phân tử O2 nhận 4 electron, là chất oxi hoá.
|
C C + 4e (quá trình oxi hoá)
|
O2 + 4e 2O (quá trình khử)
Ví dụ 2:
|
Nguyên tử C nhường 4 electron, C là chất khử:
C C + 8e (quá trình oxi hóa)
|
Phân tử O2 nhận 4 electron, là chất oxi hoá:
O2 + 4e 2O (quá trình khử)
Ví dụ 3:
|
Nguyên tử C nhận 4 electron, C là chất khử:
C C + 8e (quá trình oxi hóa)
Hình ảnh về file sile, ppt trình chiếu











.....
=> Còn nữa.... Files tải về, sẽ có đầy đủ nội dung bài học
Nâng cấp lên tài khoản VIP để tải tài liệu và dùng thêm được nhiều tiện ích khác
Từ khóa tìm kiếm:
Giáo án Powerpoint Hóa học 10 Kết nối, giáo án điện tử Hóa học 10 KNTT bài 15: Phản ứng oxi hóa – khử, giáo án trình chiếu Hóa học 10 kết nối bài 15: Phản ứng oxi hóa – khử
