Tải giáo án Powerpoint Hóa học 10 KNTT bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một chu kì và trong một nhóm
Tải giáo án trình chiếu hay còn gọi là giáo án powerpoint Hóa học 10 bộ sách Chân trời sáng tạo bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một chu kì và trong một nhóm. Soạn giáo án được thiết kế với tiêu chí đẹp mắt, hiện đại kết hợp nhiều hoạt động, trò chơi, video học tập thú vị. Phương pháp giảng dạy mới kết hợp nhiều dạng bài tập phong phú sẽ giúp học sinh nắm chắc kiến thức trọng tâm bài học. Kéo xuống để tham khảo
Rõ nét về file powerpoint trình chiếu. => Xem thêm
CHÀO MỪNG CÁC EM ĐẾN VỚI BÀI HỌC NGÀY HÔM NAY!
KHỞI ĐỘNG
Hãy dự đoán
- Trong một chu kì, bán kính nguyên tử của các nguyên tố tăng hay giảm dần?
- Trong một nhóm, bán kính của nguyên tử của các nguyên tố tăng hay giảm dần?
BÀI 6
XU HƯỚNG BIẾN ĐỔI MỘT SỐ TÍNH CHẤT CỦA NGUYÊN TỬ CÁC NGUYÊN TỐ TRONG MỘT CHU KÌ VÀ TRONG MỘT NHÓM
NỘI DUNG BÀI HỌC
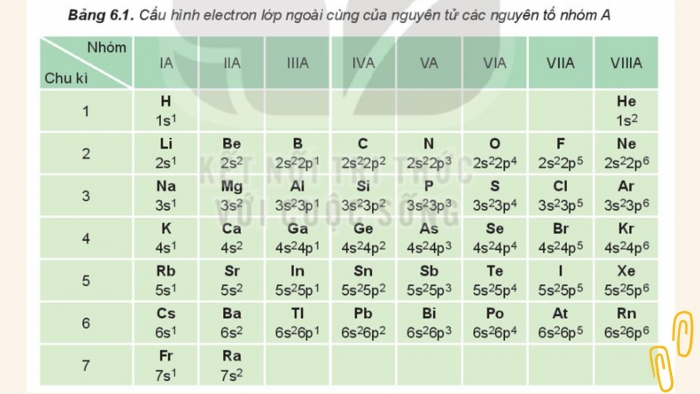
Cấu hình electron nguyên tử của các nguyên tố nhóm A
Bán kính nguyên tử
Độ âm điện
Tính kim loại và tính phi kim
- Cấu hình electron nguyên tử của các nguyên tố nhóm A
Sự biến đổi tuần hoàn của cấu hình electron lớp ngoài cùng là nguyên nhân sự biến đổi tuần hoàn về tính chất các nguyên tố.
Sau mỗi chu kì, cấu hình electron lớp ngoài cùng có lặp lại không? Điều này dẫn đến sự biến đổi như thế nào về tính chất của các nguyên tố?
Câu 1: Dựa vào bảng 6.1, cho biết số electron lớp ngoài cùng của nguyên tử các nguyên tố: Li, Al, Ar, Ca, Si, Se, P, Br.
Số elctron lớp ngoài cùng của nguyên tử các nguyên tố: Li = 1; Al = 3; Ar = 8; Ca = 2; Si = 4; Se = 6; P = 5; Br = 7.
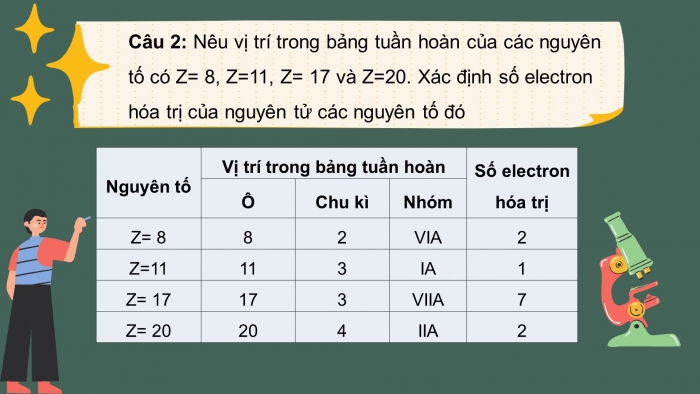
Câu 2: Nêu vị trí trong bảng tuần hoàn của các nguyên tố có Z= 8, Z=11, Z= 17 và Z=20. Xác định số electron hóa trị của nguyên tử các nguyên tố đó
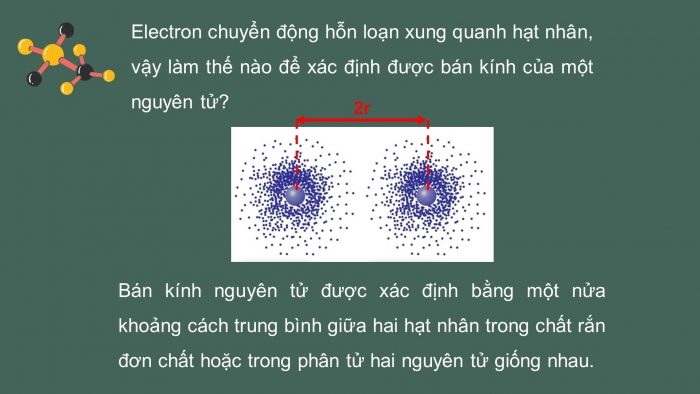
- Bán kính nguyên tử
Electron chuyển động hỗn loạn xung quanh hạt nhân, vậy làm thế nào để xác định được bán kính của một nguyên tử?
Bán kính nguyên tử được xác định bằng một nửa khoảng cách trung bình giữa hai hạt nhân trong chất rắn đơn chất hoặc trong phân tử hai nguyên tử giống nhau.
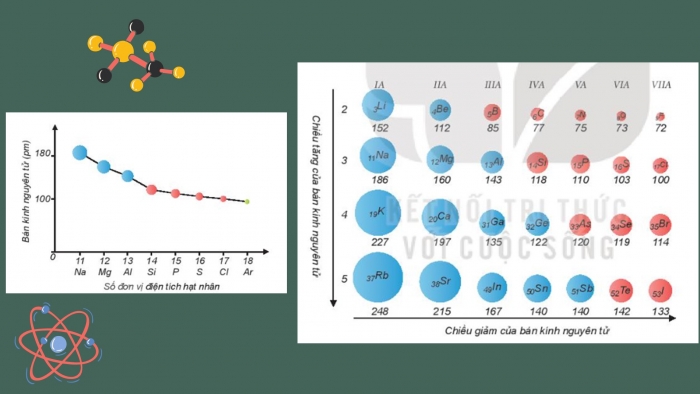
Nhận xét xu hướng biến đổi bán kính tăng dần hay giảm dần trong một chu kì, trong một nhóm A.
- Trong một chu kì, bán kính nguyên tử giảm dần theo chiều tăng dần của điện tích hạt nhân.
- Trong một nhóm A, bán kính nguyên tử tăng dần theo chiều tăng dần của điện tích hạt nhân.
Giải thích nguyên nhân xu hướng biến đổi bán kính dựa vào lực hút tĩnh điện giữa hạt nhân, các electron và số lớp electron.
- Do trong một chu kì điện tích hạt nhân tăng, số lớp electron không đổi nên lực hút giữa hạt nhân với các electron lớp ngoài cùng cũng tăng theo.
- Do trong một nhóm A, theo chiều từ trên xuống dưới số lớp electron tăng dần, bán kính nguyên tử của các nguyên tố tăng theo, mặc dù điện tích hạt nhân tăng nhanh.
Câu 3: Dựa vào bảng tuần hoàn hãy so sánh và giải thích sự khác nhau về bán kính nguyên tử của:
a, lithium (Z=3) và potassium (Z=19)
b, calcium (Z=20) và selenium (Z-34)
Đáp án
a, Lithium < potassium (cùng nhóm IA).
Trong nhóm IA, K có 4 lớp electron > Li có 2 lớp electron, lực hút giữa hạt nhân với electron lớp ngoài cùng của K < Li nên bán kính nguyên tử K > Li.
b, Calcium > selennium (cùng chu kì 4).
Trong chu kì 4, Se có 34 điện tích dương hạt nhân và 6 electron lớp ngoài cùng, lực hút giữa hạt nhân với electron lớp ngoài cùng của Se > Ca ( có 20 điện tích dương và 2 electron lớp ngoài cùng) nên bán kính nguyên tử Se < Ca.
III. Độ âm điện
Độ âm điện là gì ?
Độ âm điện (ꭓ) là đại lượng đặc trưng cho khả năng hút electron của nguyên tử một nguyên tố hóa học khi tạo thành liên kết hóa học.
Nhận xét xu hướng biến đổi giá trị độ âm điện trong một chu kì, trong một nhóm A
- Trong một chu kì, độ âm điện tăng dần từ trái qua phải.
- Trong một nhóm, độ âm điện giảm từ trên xuống dưới.
Hình ảnh về file sile, ppt trình chiếu








.....
=> Còn nữa.... Files tải về, sẽ có đầy đủ nội dung bài học
Nâng cấp lên tài khoản VIP để tải tài liệu và dùng thêm được nhiều tiện ích khác
Từ khóa tìm kiếm:
Giáo án Powerpoint Hóa học 10 Kết nối, giáo án điện tử Hóa học 10 KNTT bài 6: Xu hướng biến đổi một số, giáo án trình chiếu Hóa học 10 kết nối bài 6: Xu hướng biến đổi một số
