Tải giáo án Powerpoint Hóa học 10 KNTT bài 19: Tốc độ phản ứng
Tải giáo án trình chiếu hay còn gọi là giáo án powerpoint Hóa học 10 bộ sách Chân trời sáng tạo bài 19: Tốc độ phản ứng. Soạn giáo án được thiết kế với tiêu chí đẹp mắt, hiện đại kết hợp nhiều hoạt động, trò chơi, video học tập thú vị. Phương pháp giảng dạy mới kết hợp nhiều dạng bài tập phong phú sẽ giúp học sinh nắm chắc kiến thức trọng tâm bài học. Kéo xuống để tham khảo
Rõ nét về file powerpoint trình chiếu. => Xem thêm
CHÀO MỪNG CÁC EM ĐẾN VỚI TIẾT HỌC HÔM NAY!
KHỞI ĐỘNG
Để đánh giá mức độ nhanh chậm của phản ứng người ta đưa ra khái niệm gì?
BÀI 19. TỐC ĐỘ PHẢN ỨNG
- NỘI DUNG BÀI HỌC
- Khái niệm tốc độ phản ứng, tốc độ trung bình của phản ứng
- Định luật tác dụng khối lượng
- Các yếu tố ảnh hưởng tới tốc độ phản ứng, hệ số nhiệt độ Van’t Hoff
- Khái niệm tốc độ phản ứng, tốc độ trung bình của phản ứng
Em hãy quan sát thí nghiệm sau và trả lời
Phiếu học tập số 1.
Cho hai mảnh Mg cùng khối lượng vào 2 ống nghiệm chứa cùng thể tích dung dịch HCl dư. Nồng độ HCl ở hai ống nghiệm lần lượt là 2M và 0.5M.
Phiếu học tập số 1
- Nêu hiện tượng thí nghiệm?
- Theo em dây Mg ở ống nghiệm nào sẽ được hòa tan hết trước? Giải thích?Trong cùng một khoảng thời gian, lượng MgCl2 tạo ra ở ống nghiệm nào nhiều hơn?
- Tốc độ phản ứng của ống nghiệm nào nhanh hơn? Từ đó rút ra khái niệm về tốc độ phản ứng.
Đáp án
- Hiện tượng quan sát được trong cùng một khoảng thời gian thấy khí H2 xuất hiện ở ống nghiệm HCl 2M nhanh hơn ống nghiệm HCl 0,5M.
- Dây Mg ở ống nghiệm HCl 2M tan hết sớm hơn do phản ứng với lượng HCl nhiều hơn. Dẫn đến lượng MgCl2 tạo ra ở ống nghiệm này cũng nhiều hơn.
- Tốc độ của phản ứng hóa học là đại lượng đặc trưng cho sự thay đổi nồng độ của chất phản ứng hoặc sản phẩm trong một đơn vị thời gian.
- Phiếu học tập số 2
Nêu biểu thức tính tốc độ trung bình của phản ứng? - Cho biết tốc độ phản ứng chỉ nhận giá trị dương. Giải thích vì sao phải thêm dấu trừ trong biểu thức khi tính tốc độ trung bình của phản ứng theo các chất tham gia phản ứng.
- Hãy sắp xếp tốc độ các phản ứng sau theo chiều tăng dần: (1) phản ứng than cháy trong không khí, (2) phàn ứng gỉ sắt, (3) phản ứng nổ của khí bình gas.
- Tính tốc độ trung bình của phản ứng (4) theo O2 trong 100 giây đầu tiên: 2N2O5(g) à 4NO2(g) + O2(g)
- Từ Bảng 16.1, có thể tính được tốc độ trung bình của phản ứng sau 50 giây hay không? Vì sao?
- Bảng 16.1. Dữ liệu nồng độ các chất (mol L-1)
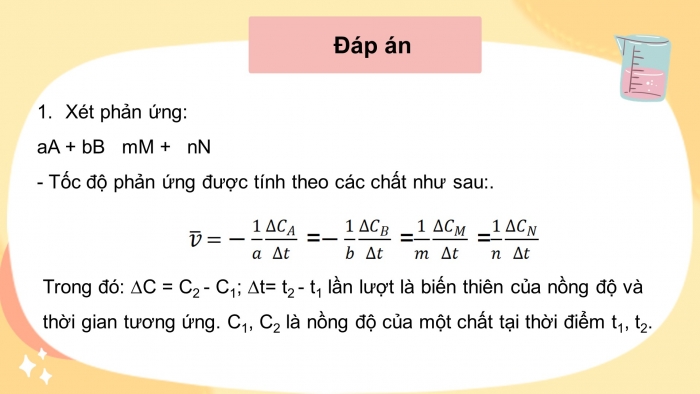
Xét phản ứng:
aA + bB mM + nN
- Tốc độ phản ứng được tính theo các chất như sau:.
Trong đó: ∆C = C2 - C1; ∆t= t2 - t1 lần lượt là biến thiên của nồng độ và thời gian tương ứng. C1, C2 là nồng độ của một chất tại thời điểm t1, t2.
- Sau thời gian phản ứng, nồng độ chất tham gia giảm
∆C < 0
Trong khi đó: ∆t = tsau - ttrước
Phải thêm dấu trừ trong biểu thức (3) đối với chất tham gia phản ứng để tốc độ phản ứng có giá trị dương.
- Sắp xếp: Tốc độ phản ứng theo chiều tăng dần: (2) < (1) < (3).
- Theo O2: Nồng độ ban đầu của O2 (C1) là 0, nồng độ sau 100s (C2) là 0,00155M.
Δt = 100 s – 0 s = 100 s. Vậy tốc độ trung bình của phản ứng trong 100 s đầu tiên là:
(M.s-1)
- Nồng độ biến thiên chất không đồng đều sau mỗi khoảng đơn vị thời gian.
→ Không thể tính được nồng độ các chất sau 50 giây
→Không tính được tốc độ trung bình của phản ứng sau 50 giây
Hình ảnh về file sile, ppt trình chiếu











.....
=> Còn nữa.... Files tải về, sẽ có đầy đủ nội dung bài học
Nâng cấp lên tài khoản VIP để tải tài liệu và dùng thêm được nhiều tiện ích khác
Từ khóa tìm kiếm:
Giáo án Powerpoint Hóa học 10 Kết nối, giáo án điện tử Hóa học 10 KNTT bài 19: Tốc độ phản ứng, giáo án trình chiếu Hóa học 10 kết nối bài 19: Tốc độ phản ứng
