Tải bản chuẩn giáo án chuyên đề Hóa học 10 cánh diều bài 4: Entropy và biến thiên năng lượng tự do Gibbs
Tải bản chuẩn giáo án chuyên đề học tập Hóa học 10 bộ sách mới cánh diều bài 4: Entropy và biến thiên năng lượng tự do Gibbs. giáo án soạn ch1 t1ết, hướng dẫn học sinh hoạt động để tìm tò1, khám phá ra k1ến thức mới, vận dụng chúng vào v1ệc giải quyết các vấn đề của học tập và của thực tiễn cuộc sống. Mờ1 thầy cô kéo xuống tham khảo
Rõ nét về file powerpoint trình chiếu. => Xem thêm
Ngày soạn: .../.../...
Ngày dạy: .../.../...
BÀI 4: ENTROPY VÀ BIẾN THIÊN NĂNG LƯỢNG TỰ DO GIBBS (3 TIẾT)
- MỤC TIÊU:
- Kiến thức: Học xong bài này, HS đạt các yêu cầu sau:
- Nêu được khái niệm và ý nghĩa entropy.
- Nêu được ý nghĩa của dấu và trị số của biến thiên năng lượng tự do Gibbs .
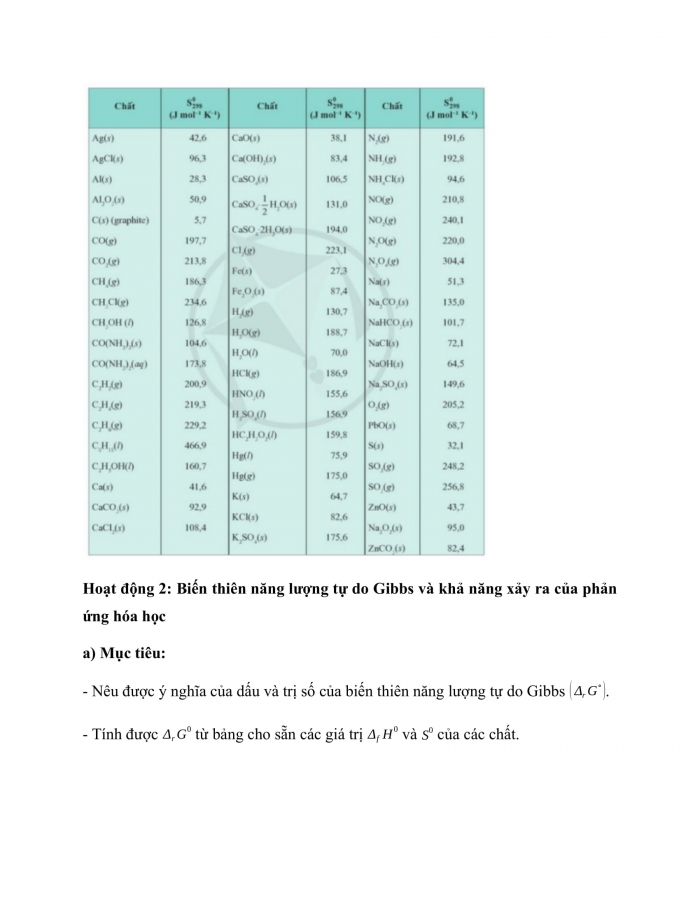
- Tính được từ bảng cho sẵn các giá trị và của các chất.
- Năng lực
- Năng lực chung:
- Năng lực tự chủ và tự học trong tìm tòi khám phá
- Năng lực giao tiếp và hợp tác trong trình bày, thảo luận và làm việc nhóm
- Năng lực giải quyết vấn đề và sáng tạo trong thực hành, vận dụng.
Năng lực riêng:
- Nhận thức hoá học: Nêu được khái niệm, ý nghĩa của entropy S. Nêu được ý nghĩa của biến thiên năng lượng tự do Gibbs. Tính được .
- Tìm hiểu thế giới tự nhiên dưới góc độ hoá học.
- Vận dụng kiếnthức, kĩ năng đã học: Vận dụng kiến thức, kĩ năng để giải quyết một số bài tập có gắn với thực tiễn như: đánh giá được phản ứng có tự diễn ra hay không, xác định được nhiệt độ nào thì phản ứng diễn ra.
- Phẩm chất
- Có ý thức học tập, ý thức tìm tòi, khám phá và sáng tạo, có ý thức làm việc nhóm, tôn trọng ý kiến các thành viên khi hợp tác.
- Chăm chỉ tích cực xây dựng bài, có trách nhiệm, chủ động chiếm lĩnh kiến thức theo sự hướng dẫn của GV.
- THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
- Đối với GV: SGK, Tài liệu giảng dạy, giáo án, đồ dùng dạy học, hình ảnh về sự biến đổi entropy của một số chất.
- Đối với HS: SGK, SBT, vở ghi, giấy nháp, đồ dùng học tập (bút, thước...), bảng nhóm, bút viết bảng nhóm.
III. TIẾN TRÌNH DẠY HỌC
- HOẠT ĐỘNG KHỞI ĐỘNG (MỞ ĐẦU)
- a) Mục tiêu:
- Huy động vốn kiến thức đã học về thể của chất, ba thể của chất và đặc điểm của chúng để tìm hiểu về trật từ sắp xếp các phân tử nước ở ba thể rắn, lỏng, khí.
- b) Nội dung: HS đọc tình huống mở đầu, suy nghĩ trả lời câu hỏi.
- c) Sản phẩm: Câu trả lời của học sinh.
- d) Tổ chức thực hiện:
Bước 1: Chuyển giao nhiệm vụ:
- GV cho HS đọc tình huống mở đầu:
Hình 4.1 mô tả trật tự sắp xếp của các phân tử nước ở ba thể: rắn, lỏng và khí. Em hãy cho biết mức độ "mất trật tự" của hệ tăng hay giảm theo chiều từ nước đá hơi nước.
Bước 2: Thực hiện nhiệm vụ: HS quan sát và chú ý lắng nghe, thảo luận nhóm đôi hoàn thành yêu cầu.
Bước 3: Báo cáo, thảo luận: GV gọi một số HS trả lời, HS khác nhận xét, bổ sung.
Dự kiến câu trả lời:
Mức độ "mất trật tự" của hệ tăng theo chiều từ nước đá tới hơi nước.
Bước 4: Kết luận, nhận định: GV đánh giá kết quả của HS, trên cơ sở đó dẫn dắt HS vào bài học mới.
- HÌNH THÀNH KIẾN THỨC MỚI
Hoạt động 1: Tìm hiểu khái niệm entropy
- a) Mục tiêu:
- Nêu được khái niệm và ý nghĩa của entropy.
- Tính biến thiên entropy của một phản ứng hoặc một quá trình.
- b) Nội dung:
HS đọc SGK, nghe giảng, thực hiện các nhiệm vụ được giao, đọc hiểu ví dụ, trả lời câu hỏi 1, 2, Luyện tập 1, 2.
- c) Sản phẩm: HS hình thành được kiến thức bài học, nêu được khái niệm và ý nghĩa của entropy, tính được biến thiên entropy.
- d) Tổ chức thực hiện:
|
HĐ CỦA GV VÀ HS |
SẢN PHẨM DỰ KIẾN |
|
Bước 1: Chuyển giao nhiệm vụ: Nhiệm vụ 1: Tìm hiểu về khái niệm entropy - GV cho HS tìm hiểu nội dung về quá trình hòa tan muối ăn:
+ HS trả lời câu hỏi 1 (SGK -tr29) - GV cho HS tìm hiểu nội dung SGK, đặt câu hỏi: + Entropy là gì? + Nêu ý nghĩa của entropy, đơn vị, kí hiệu của entropy chuẩn của chất.
Nhiệm vụ 2: Tính biến thiên entropy của phản ứng hóa học - GV đặt câu hỏi: Biến thiên entropy chuẩn của phản ứng được tính theo công thức nào? Nêu ý nghĩa các kí hiệu trong công thức. - GV giới thiệu entropy chuẩn của một số chất. - HS thảo luận nhóm 2, trả lời Câu hỏi 2 (SGK -tr29) - HS đọc Ví dụ 1, 2 yêu cầu HS giải thích, trình bày lại. - HS thảo luận nhóm 2 thực hiện Luyện tập 1, 2 (SGK -tr30). Bước 2: Thực hiện nhiệm vụ: - HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức, hoàn thành các yêu cầu. - GV quan sát, hướng dẫn. Bước 3: Báo cáo, thảo luận: - HS giơ tay phát biểu, lên bảng trình bày - Một số HS khác nhận xét, bổ sung cho bạn. Bước 4: Kết luận, nhận định: GV tổng quát lưu ý lại kiến thức trọng tâm và yêu cầu HS ghi chép đầy đủ vào vở. |
I. Entropy Câu hỏi 1: Khi đun nóng chảy tinh thể NaCl, độ mất trật tự của các ion tăng vì muối ăn đã chuyển từ trạng thái tinh thể sang trạng thái lỏng. 1. Ý nghĩa entropy - Entropy là đại lượng đặc trưng cho độ mất trật tự của một hệ ở một trạng thái và điều kiện xác định. - Độ mất trật tự của hệ càng cao, entropy của hệ càng lớn. - Đơn vị của entropy thường là J mol-1 K-1. - Entropy của một chất ở điều kiện chuẩn (298 K, 1 bar) gọi là entropy chuẩn của chất, kí hiệu 2. Tính biến thiên entropy của một phản ứng hoặc một quá trình Biến thiên entropy chuẩn của một quá trình, kí hiệu là được tính như sau: Xét phản ứng: Câu hỏi 2: (J K-1) Ví dụ 1, 2 (SGK -tr29) Luyện tập 1:
b) c) Luyện tập 2: Độ “mất trật tự” của phân tử hơi nước là lớn hơn các phân tử nước lỏng ⇒ Entropy của hơi nước (H2O(g)) lớn hơn entropy của nước lỏng (H2O(l)) Suy ra dương. |
Hoạt động 2: Biến thiên năng lượng tự do Gibbs và khả năng xảy ra của phản ứng hóa học
- a) Mục tiêu:
- Nêu được ý nghĩa của dấu và trị số của biến thiên năng lượng tự do Gibbs .
- Tính được từ bảng cho sẵn các giá trị và của các chất.
- b) Nội dung: HS đọc SGK để tìm hiểu nội dung kiến thức theo yêu cầu của GV, chú ý nghe giảng, thực hiện các nhiệm vụ, trả lời Câu hỏi, đọc hiểu Ví dụ, làm Vận dụng.
- c) Sản phẩm: HS nêu được ý nghĩa của biến thiên năng lượng tự do, tính được , dự đoán hoặc giải thích một chiều hướng của phản ứng dựa vào biến thiên năng lượng tự do Gibbs.
- d) Tổ chức thực hiện:
|
HOẠT ĐỘNG CỦA GV VÀ HS |
SẢN PHẨM DỰ KIẾN |
|
Bước 1: Chuyển giao nhiệm vụ: - GV dẫn dắt: đại lượng nào cho biết khả năng xảy ra một phản ứng hóa học hoặc một quá trình nói chung? - GV cho HS tìm hiểu nội dung SGK, trả lời câu hỏi: + Viết biểu thức tính biến thiên năng lượng tự do Gibbs. Cho biết tên các kí hiệu trong biểu thức. + Nêu ý nghĩa của dấu và trị số của biến thiên năng lượng tự do Gibbs. - HS đọc Ví dụ 3, GV hướng dẫn cách làm. - GV chia lớp thành 3 tổ, HS thực hiện và thảo luận theo nhóm 4. + Tổ 1: trả lời câu hỏi Luyện tập 3a. + Tổ 2: trả lời câu hỏi Luyện tập 3b. + Tổ 3: trả lời câu hỏi Luyện tập 3c. - HS thảo luận nhóm 4, đọc hiểu Ví dụ 4, 5 và thực hiện Vận dụng 1, 2, 3 (SGK -tr31). Bước 2: Thực hiện nhiệm vụ: - HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức, hoàn thành các yêu cầu, thảo luận nhóm. - GV: quan sát và trợ giúp HS. Bước 3: Báo cáo, thảo luận: - HS giơ tay phát biểu, lên bảng trình bày - Một số HS khác nhận xét, bổ sung cho bạn. Bước 4: Kết luận, nhận định: GV tổng quát lưu ý lại kiến thức trọng tâm và yêu cầu HS ghi chép đầy đủ vào vở. |
II. Biến thiên năng lượng tự do Gibbs và khả năng xảy ra của phản ứng hóa học - Biến thiên năng lượng tự do Gibbs ( là đại lượng liên hệ các yếu tố và nhiệt độ T. Trong đó: : biến thiên enthalpy chuẩn của phản ứng ở nhiệt độ T; : biến thiên entropy chuẩn của phản ứng ở nhiệt độ T; T: nhiệt độ tại đó xảy ra phản ứng (theo thang Kelvin); : biến thiên năng lượng tự do Gibbs chuẩn của phản ứng ở nhiệt độ T. Dựa vào có thể dự đoán hoặc giải thích được chiều hướng của một phản ứng hóa học ở nhiệt độ T: + phản ứng sẽ tự xảy ra + phản ứng không tự xảy ra. Ví dụ 3 (SGK -tr30+31) Luyện tập 3: a)
Vậy ở điều kiện chuẩn phản ứng này tự xảy ra. b)
Vậy ở điều kiện chuẩn phản ứng này tự xảy ra. c)
Vậy ở điều kiện chuẩn phản ứng này tự xảy ra. Vận dụng 1: Phản ứng (2): 2NO(g) + O2(g) 2NO(g) Trong phản ứng (2), có giá trị âm hơn . Vì thế ở nhiệt độ thấp hơn thì phản ứng diễn ra thuận lợi hơn. Ví dụ 4, 5 (SGK -tr30) Vận dụng 2: Phản ứng (3) trong thực tế còn gọi là phản ứng nung vôi. Vận dụng 3: Mặc dù phản ứng (3) có thể xảy ra ở nhiệt độ 848oC, nhưng trong thực tế người ta thường nung nóng CaCO3 tới nhiệt độ 1 000oC vì ở nhiệt độ khoảng 1 000oC thì phản ứng xảy ra mãnh liệt làm tăng năng suất sản xuất vôi sống từ đá vôi. |
- HOẠT ĐỘNG LUYỆN TẬP
- a) Mục tiêu: Học sinh củng cố lại kiến thức đã học.
- b) Nội dung: HS vận dụng các kiến thức của bài học làm Bài 1, 2, 3, 4 (SGK -tr32, 33).
- c) Sản phẩm học tập: HS giải được bài về entropy và năng lượng tự do Gibbs.
- d) Tổ chức thực hiện:
Bước 1: Chuyển giao nhiệm vụ:
- GV tổng hợp các kiến thức cần ghi nhớ cho HS.
- GV tổ chức cho HS hoạt động theo nhóm thực hiện Bài 1, 2, 3, 4 (SGK -tr32, 33).
Bước 2: Thực hiện nhiệm vụ: HS quan sát và chú ý lắng nghe, thảo luận nhóm, hoàn thành các bài tập GV yêu cầu.
- GV quan sát và hỗ trợ.
Bước 3: Báo cáo, thảo luận:
- Mỗi bài tập GV mời HS trình bày. Các HS khác chú ý chữa bài, theo dõi nhận xét bài trên bảng.
Bước 4: Kết luận, nhận định:
- GV nhận xét thái độ làm việc, phương án trả lời của các học sinh, ghi nhận và tuyên dương
Kết quả:
Bài 1: Entropy của quá trình hòa tan K2Cr2O7 tăng lên do khi chuyển từ dạng tinh thể vào dạng chất tan (phân li) thì độ mất trật tự tăng lên.
Bài 2:
Do âm nên phản ứng tự diễn ra ở nhiệt độ thường, tạo một lớp Al2O3 bền bảo vệ đồ vật bằng nhôm ngăn cho nhôm không tham gia các phản ứng khác.
Bài 3:
Thực nghiệm đo được giá trị nhỏ hơn giá trị .
Bài 4:
- a) Ở tức
- 298.
Phản ứng không tự xảy ra ở . - b) Ở tức
Phản ứng không tự xảy ra ở . - HOẠT ĐỘNG VẬN DỤNG
- a) Mục tiêu:
- Học sinh thực hiện làm bài tập vận dụng để nắm vững kiến thức.
- b) Nội dung: HS sử dụng SGK và vận dụng kiến thức đã học để làm bài tập.
- c) Sản phẩm: HS vận dụng kiến thức đã học giải quyết được bài toán entropy và năng lượng tự do Gibbs, dự đoán được chiều hướng của phản ứng.
- d) Tổ chức thực hiện:
Bước 1: Chuyển giao nhiệm vụ
- HS thảo luận nhóm, làm các bài tập Bài 5, 6, 7 (SGK -tr33)
Bước 2: Thực hiện nhiệm vụ
- HS suy nghĩ, trao đổi, thảo luận thực hiện nhiệm vụ.
- GV điều hành, quan sát, hỗ trợ.
Bước 3: Báo cáo, thảo luận
- Bài tập: đại diện HS trình bày kết quả thảo luận, các HS khác theo dõi, đưa ý kiến.
Bước 4: Kết luận, nhận định
- GV nhận xét, đánh giá, đưa ra đáp án đúng, chú ý các lỗi sai của học sinh hay mắc phải.
Đáp án:
Bài 5:
- l)
Để phản ứng diễn ra cần có
- T.
hay .
Bài 6:
Ở điều kiện thường có thể tự xảy ra quá trình sắt bị biến đổi thành .
Bài 7:
Để dự đoán khả năng xảy ra phản ứng cần sử dụng biến thiên năng lượng tự do Gibbs bởi vì biến thiên năng lượng tự do Gibbs chứa cả yếu tố entropy. Có nhiều quá trình tự xảy ra mà không có sự thay đổi về enthalpy nhưng có sự thay đổi về entropy (ví dụ: quá trình tự trộn lẫn hai chất khí (quá trình khuếch tan) khi tháo bỏ lớp ngăn cách giữa hai bình khí, có do mặc dù nên tự diễn ra).
* HƯỚNG DẪN VỀ NHÀ
- Ghi nhớ kiến thức trong bài.
- Hoàn thành các bài tập trong SBT
- Chuẩn bị bài mới "Bài 5: Sơ lược về phản ứng cháy, nổ"
Hình ảnh về file sile, ppt trình chiếu







.....
=> Còn nữa.... Files tải về, sẽ có đầy đủ nội dung bài học
Nâng cấp lên tài khoản VIP để tải tài liệu và dùng thêm được nhiều tiện ích khác
Từ khóa tìm kiếm:
Tải bản chuẩn giáo án chuyên đề Hóa học 10 Cánh diều, giáo án chuyên đề học tập Hóa học 10 Cánh diều bài 4: Entropy và biến thiên năng lượng, soạn giáo án chuyên đề Hóa học 10 cánh diều bài 4: Entropy và biến thiên năng lượng
