Tải giáo án Powerpoint KHTN 8 KNTT Bài 6: Tính theo phương trình hoá học
Tải bài giảng điện tử powerpoint khoa học tự nhiên 8 kết nối tri thức Bài 6: Tính theo phương trình hoá học. Bài học được thiết kể đẹp mắt, nội dung giảng dạy hay nhiều trò chơi và video phong phú thu hút học sinh tập trung nắm bắt kiến thức quan trong. Giáo án tải về chỉnh sửa được. Kéo xuống để xem chi tiết
Rõ nét về file powerpoint trình chiếu. => Xem thêm
NHIỆT LIỆT CHÀO MỪNG CÁC EM ĐẾN VỚI BÀI HỌC MỚI
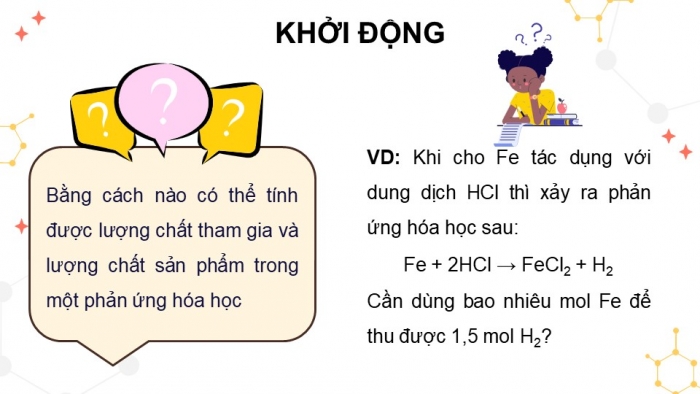
KHỞI ĐỘNG
Bằng cách nào có thể tính được lượng chất tham gia và lượng chất sản phẩm trong một phản ứng hóa học
VD: Khi cho Fe tác dụng với dung dịch HCl thì xảy ra phản ứng hóa học sau:
Fe + 2HCl → FeCl2 + H2
Cần dùng bao nhiêu mol Fe để thu được 1,5 mol H2?
BÀI 6. TÍNH THEO PHƯƠNG TRÌNH HOÁ HỌC
NỘI DUNG BÀI HỌC
Tính lượng chất trong phương trình hóa học
Hiệu suất phản ứng
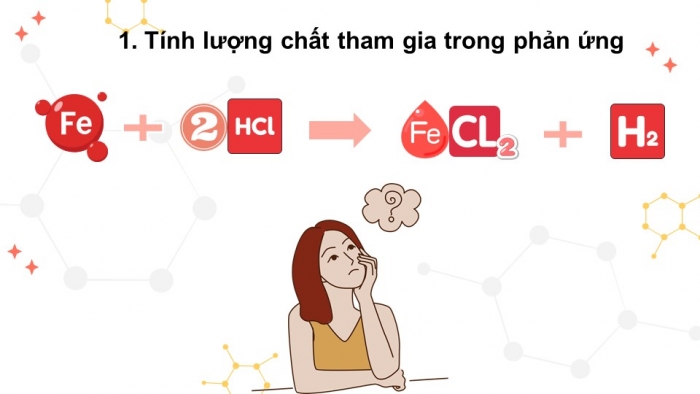
01 TÍNH LƯỢNG CHẤT TRONG PHƯƠNG TRÌNH HÓA HỌC
- Tính lượng chất tham gia trong phản ứng
Ví dụ 1
Khi cho Fe tác dụng với dung dịch HCl thì xảy ra phản ứng hóa học sau:
Fe + 2HCl → FeCl2 + H2
Cần dùng bao nhiêu mol Fe để thu được 1,5 mol H2?
BÀI GIẢI
Theo phương trình hóa học:
1 mol Fe tham gia phản ứng sẽ thu được 1 mol H2.
Vậy: 1,5 mol Fe ………………………………
1,5 mol H2.
Số mol Fe cần dùng để thu được 1,5 mol H2 là 1,5 mol.
- Tính lượng chất sinh ra trong phản ứng
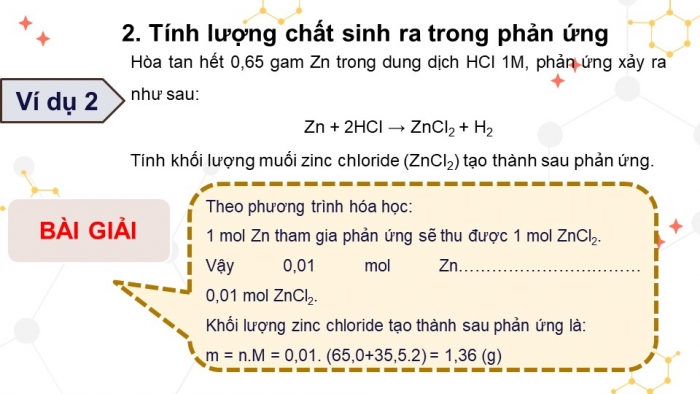
Ví dụ 2
Hòa tan hết 0,65 gam Zn trong dung dịch HCl 1M, phản ứng xảy ra như sau:
Zn + 2HCl → ZnCl2 + H2
Tính khối lượng muối zinc chloride (ZnCl2) tạo thành sau phản ứng.
BÀI GIẢI
Theo phương trình hóa học:
1 mol Zn tham gia phản ứng sẽ thu được 1 mol ZnCl2.
Vậy 0,01 mol Zn……………………………
0,01 mol ZnCl2.
Khối lượng zinc chloride tạo thành sau phản ứng là:
m = n.M = 0,01. (65,0+35,5.2) = 1,36 (g)
Câu 1: Tính thể tích khí hydrogen thu được trong ví dụ trên 25oC, 1 bar
Câu 2: Khi cho Mg tác dụng với dung dịch H2SO4 loãng thì xảy ra phản ứng hóa học như sau:
Mg + H2SO4 → MgSO4 + H2
Sau phản ứng thu được 0,02 mol MgSO4 . Tính thể tích khí H2 thu được ở 25oC, 1 bar
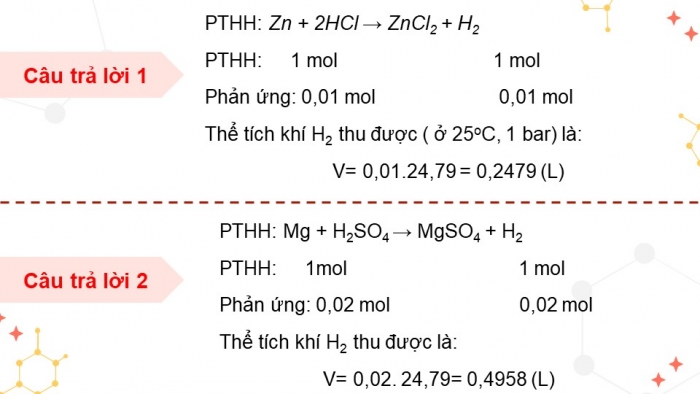
Câu trả lời 1
PTHH: Zn + 2HCl → ZnCl2 + H2
PTHH: 1 mol 1 mol
Phản ứng: 0,01 mol 0,01 mol
Thể tích khí H2 thu được ( ở 25oC, 1 bar) là:
V= 0,01.24,79 = 0,2479 (L)
Câu trả lời 2
PTHH: Mg + H2SO4 → MgSO4 + H2
PTHH: 1mol 1 mol
Phản ứng: 0,02 mol 0,02 mol
Thể tích khí H2 thu được là:
V= 0,02. 24,79= 0,4958 (L)
Kết luận: Dựa vào phương trình hóa học, khi biết lượng một chất đã phản ứng hoặc lượng chất tạo thành, tính được lượng các chất còn lại.
02 HIỆU SUẤT PHẢN ỨNG
- Khái niệm hiệu suất phản ứng
Ví dụ 1
Xét phản ứng khi đốt cháy 1 mol Carbon:
C + O2 CO2
Theo phương trình hóa học:
Nếu 1 mol C cháy hết, thu được 1 mol CO2 thì hiệu suất phản ứng đạt 100%. Tuy nhiên, trong thực tế số mol CO2 thu được thường nhỏ hơn 1 mol. Xét phản ứng trong trường hợp tổng quát:
Chất phản ứng → Sản phẩm
Ví dụ 2
- Khi nung 1 mol đá vôi ( có thành phần CaCO3):
CaCO3 CaO + CO2
Lượng CaO thu được là một số nhỏ hơn 1 mol vì thực tế trong đá vôi còn chứa tạp chất, thời gian phản ứng chưa đủ lâu,..
- Phản ứng của một số hợp chất hữu cơ thường không xảy ra hoàn toàn, nhiều phản ứng phụ,…
Với hiệu suất phản ứng nhỏ hơn 100%, khi đó
Lượng chất phản ứng dùng trên thực tế sẽ lớn lơn lượng tính theo phương trình hóa học (theo lý thuyết)
Lượng sản phẩm thu được trên thực tế sẽ nhỏ hơn lượng tính theo phương trình hóa học
Câu hỏi: Khi nung nóng xảy ra phản ứng hóa học sau (phản ứng nhiệt phân):
Biết rằng hiệu suất phản ứng nhỏ hơn 100%.
- Khi nhiệt phân 1 mol thì thu được số mol lớn hơn/nhỏ hơn/ bằng 1,5 mol?
- Để thu được 0,3 mol thì cần số mol lớn hơn/ nhỏ hơn/ bằng 0,2 mol?
- Tính hiệu suất của phản ứng
m’ : khối lượng chất sản phẩm thực tế
m: khối lượng chất theo sản phẩm lý thuyết
n’ : số mol chất sản phẩm thực tế
n: số mol chất sản phẩm lý thuyết
Câu hỏi: Nung 10 gam calcium carbonate (thành phần chính của đá vôi), thu được khí carbon dioxide và m gam vôi sống. Giả thiết hiệu suất phản ứng là 80%, xác định m.
Cách 1
Số mol CaCO3 là 0,1 mol
PTHH: CaCO3 CaO + CO2
Tỉ lệ: 1mol 1mol
Phản ứng: 0,1mol 0,1mol
Khối lượng CaO thu được theo phương trình phản ứng là: 0,1 . 56 = 5,6 (g)
Thực tế, khối lượng CaO thu được là:
Cách 2
Thực tế khối lượng CaCO3 phản ứng là :
Số mol CaCO3 phản ứng là 0,08 mol.
PTHH: CaCO3 CaO + CO2
Tỉ lệ: 1mol 1mol
Phản ứng: 0,08mol 0,08mol
Theo phương trình phản ứng, khối lượng CaO tạo thành là: 0,08.56 = 4,48 (g).
HÁI HOA DÂN CHỦ
Hình ảnh về file sile, ppt trình chiếu







.....
=> Còn nữa.... Files tải về, sẽ có đầy đủ nội dung bài học
TẢI GIÁO ÁN POWERPOINT BẢN ĐẦY ĐỦ:
- Giáo án powerpoint, dễ dàng chỉnh sửa nếu muốn
- Sinh động, hiện đại, đẹp mắt để tạo hứng thú học cho học sinh
- Giáo án có đủ Lí + Hóa + sinh
THỜI GIAN BÀN GIAO GIÁO ÁN:
Nhận đủ cả năm ngay sau thanh toán
PHÍ GIÁO ÁN:
- Word: 500k/kì - 550k/cả năm
- Powerpoint: 600k/kì - 700k/cả năm
- Word + Powerpoint: 800k/kì - 900k/cả năm
=> Tặng kèm nhiều tài liệu tham khảo khi mua giáo án:
- Đề thi
- Trắc nghiệm
CÁCH ĐẶT TRƯỚC:
- Bước 1: gửi phí vào tk: 10711017 - Chu Văn Trí - Ngân hàng ACB (QR)
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo đặt trước
Từ khóa tìm kiếm:
Bài giảng điện tử khoa học tự nhiên 8 KNTT, giáo án điện tử khoa học tự nhiên 8 kết nối Bài 6: Tính theo phương trình hoá học, giáo án powerpoint khoa học tự nhiên 8 kết nối tri thức Bài 6: Tính theo phương trình hoá học
